
【题目】H2S是一种剧毒气体,工业生产中可以通过多种手段对其进行回收或再利用。
Ⅰ.900℃时可以用克劳斯法回收H2S气体,该过程中涉及的部分反应如下:
①2H2S(g)+O2(g)![]() S2(g)+2H2O(g) △H=-316.8kJmol-1
S2(g)+2H2O(g) △H=-316.8kJmol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=-1040.2kJmol-1
(1)4H2S(g)+2SO2(g)![]() 3S2(g)+4H2O(g)的△H=___
3S2(g)+4H2O(g)的△H=___
(2)若在900℃以上绝热、恒容的密闭容器中,投入一定量的H2S、O2发生反应①,下列说法能说明反应达到平衡状态的是___
a.混合气体密度不随时间变化而变化
b.v正(O2)=2v逆(H2O)
c.体系压强不随时间变化而变化
d.反应体系温度不变
e.混合气体平均相对分子质量不变
f.单位时间内生成nmolS2,同时生成2nmolH2S
Ⅱ.工业上还可以通过硫化氢分解对其进行处理、利用:2H2S(g)![]() S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图1所示:
S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图1所示:
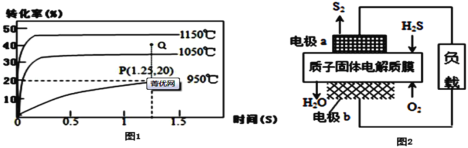
(3)950℃时,0~1.25s生成S2(g)的平均反应速率为___
(4)该反应的△H___0(填“>”“<”或“=”),1050℃达到平衡时H2S的转化率为35%,则该温度下,平衡常数K=___(保留一位有效数字),该温度下Q点时反应___(填“正向移动”“逆向移动”或“不移动”)
Ⅲ.对H2S废气进行利用的另一种途径是将其设计成质子膜—H2S燃料电池,反应原理为2H2S(g)+O2(g)═S2(s)+2H2O(l)。电池结构示意图如图2:
(5)电极a上发生的电极反应式为___。
(6)设NA为阿伏伽德罗常数的值,当电路中通过3mol电子时,通过质子膜进入___(填“正极区”或“负极区”)的H+数目为___。
【答案】+89.8kJmol-1 cdf 0.004molL-1s-1 > 0.003 逆向移动 2H2S-4e-=S2+4H+ 正极区 3NA
【解析】
根据盖斯定律进行ΔH的计算,分析条件是否为“变量”判断能否作为达到平衡的标志,根据公式![]() 计算化学反应速率,结合三段式计算平衡常数,根据原电池原理书写电极反应方程式并进行相关计算。
计算化学反应速率,结合三段式计算平衡常数,根据原电池原理书写电极反应方程式并进行相关计算。
Ⅰ.(1)已知①2H2S(g)+O2(g)![]() S2(g)+2H2O(g)△H=-316.8kJmol-1
S2(g)+2H2O(g)△H=-316.8kJmol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)△H=-1040.2kJmol-1
根据盖斯定律,反应①×3-②可得反应4H2S(g)+2SO2(g)![]() 3S2(g)+4H2O(g),则△H=(-316.8kJmol-1)×3-(-1040.2kJmol-1)=+89.8 kJmol-1;
3S2(g)+4H2O(g),则△H=(-316.8kJmol-1)×3-(-1040.2kJmol-1)=+89.8 kJmol-1;
(2)绝热、恒容的密闭容器中,对于反应2H2S(g)+O2(g)![]() S2(g)+2H2O(g):
S2(g)+2H2O(g):
a.由质量守恒可知反应前后气体总质量不变,又恒容密闭容器,则无论反应是否达到平衡,混合气体的密度始终不变,a不符合题意;
b.根据化学反应速率与化学计量数成正比分析可知,2v正(O2)=v逆(H2O)时,反应正逆反应速率相等,而v正(O2)=0.5v正(H2O)<2v逆(H2O),反应逆向进行,b不符合题意;
c.反应①为放热反应,绝热密闭容器中,随着反应的进行,温度上高,压强增大,则反应体系压强不随时间变化而变化时,说明反应达到平衡,c符合题意;
d.反应①为放热反应,绝热密闭容器中,随着反应的进行,温度上高,当反应体系温度不变时,说明反应达到平衡,d符合题意;
e.反应前后气体的物质的量不变,总质量不变,则混合气体平均相对分子质量始终不变,不能说明反应达到平衡,e不符合题意;
f.单位时间内生成nmolS2,同时生成2nmolH2S,则正逆反应速率相等,说明反应达到平衡,f符合题意;
故答案为:cdf;
Ⅱ.(3)根据图1数据可知,950℃时,0~1.25s内H2S的转化率为20%,则反应了0.1×20%=0.02molH2S,根据方程式可知生成了0.01molS2,则生成S2的平均反应速率 ;
;
(4)由图可知,升高温度,H2S的转化率增大,即反应正向进行,则正反应为吸热反应,ΔH>0,1050℃达到平衡时H2S的转化率为35%,则可列平衡三段式为:

平衡常数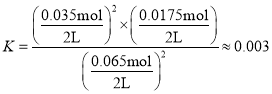 ,该温度下,Q点时,转化率增大,所以Qc>K,平衡逆向移动;
,该温度下,Q点时,转化率增大,所以Qc>K,平衡逆向移动;
Ⅲ.(5)根据电池工作原理图分析可知,H2S在电极a失去电子发生氧化反应生成S2,则电极a为原电池负极,电极反应为2H2S-4e-=S2+4H+;
(6)原电池中阳离子向正极移动,根据电极a的电极反应2H2S-4e-=S2+4H+可知,当电路中通过3mol电子时,3molH+通过质子膜进入正极区,数目为3NA。


科目:高中化学 来源: 题型:
【题目】(1)比较熔点:![]() 晶体_______白磷晶体(填“>”、“<”或“=”),判断的理由是_______________;
晶体_______白磷晶体(填“>”、“<”或“=”),判断的理由是_______________;
(2)酸碱质子理论认为,能电离出质子(氢离子)的物质是酸,能结合质子的物质是碱,用一个离子方程式说明:![]() 与
与![]() 的碱性强弱________________;
的碱性强弱________________;
(3)一水合氨![]() 分子中,
分子中,![]() 与
与![]() 实际上是通过氢键相结合,请结合一水合氨的性质,用结构式画出一水合氨最有可能的分子结构____________。
实际上是通过氢键相结合,请结合一水合氨的性质,用结构式画出一水合氨最有可能的分子结构____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使___,灼烧后的坩埚应放在___上,不能直接放在桌面上。
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是___。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___、冷却结晶、___、自然干燥。
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是:____。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x值偏高,可能的原因是___。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系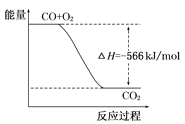
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO3(g),反应过程中能量的变化如图所示。
2SO3(g),反应过程中能量的变化如图所示。
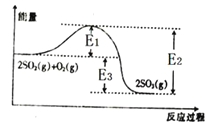
(1)由图可知该反应的正反应为_______(填“吸热”或“放热”)反应。
(2)向反应体系中加入催化剂后,图中E1_____(填“增大”“减小”或“不变”,下同),E3______。
Ⅱ、如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
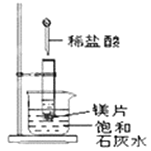
(3)写出试管内反应的离子方程式___________________________;
(4)实验中观察到石灰水中的现象:Ⅰ镁片溶解、Ⅱ镁片上产生大量气泡、Ⅲ_________________,产生上述现象Ⅲ的原因是____________________________。
(5)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaClO溶液中通入过量CO2:ClO-+ CO2 + H2O = HClO + HCO![]()
B.向FeCl3溶液中加入铜粉:Fe3+ + Cu = Fe2+ + Cu2+
C.用NaOH溶液吸收NO2:2OH-+ 2NO2 = 2NO![]() + H2O
+ H2O
D.向AlCl3溶液中滴加氨水:Al3+ + 3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
下列说法正确的是( )
A.H2(g)的燃烧热为571.6kJ·mol-1
B.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
C.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
D.等质量的H2(g)和CH3OH(l)完全燃烧,H2(g)燃烧放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论不正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论不正确的是( )
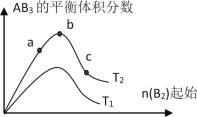
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是吸热反应
D.达到平衡时,AB3的物质的量大小为:c > b > a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
下列说法不正确的是( )
A.前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B.达到平衡时,需要从外界吸收的能量为0.968 kJ
C.增大水的浓度,可以改变待反应的限度
D.使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com