
下列关于氧化物的叙述中正确的是 ( )。
A.酸性氧化物均可与可溶性碱起反应
B.酸性氧化物在常温下均为气态
C.不能跟酸反应的氧化物一定能跟碱反应
D.氧化物与水的反应都是化合反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 1-1 物质的分类、转化及分散系练习卷(解析版) 题型:选择题
我国科学家在世界上第一次为一种名为“钴酞箐”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞箐”分子的结构和性质与人体内的血红素和植物的叶绿素非常相似。下列关于“钴酞箐”分子的说法中正确的是 ( )
A.它的分子直径比Na+小
B.它的分子既能透过滤纸,也能透过半透膜
C.在水中形成的分散系能产生丁达尔效应
D.在水中所形成的分散系属悬浊液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:填空题
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(2)实验③中的现象为 。
(3)实验①、②中反应的离子方程式分别是 、 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )。
A.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42-
B.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO-
C.能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl-
D.pH=0的溶液中:Mg2+、Na+、F-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:选择题
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )。
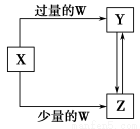
选项ABCD
XCFeCa(OH)2溶液AlCl3
WO2HNO3CO2NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:填空题
在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是 、 。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是 。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过 mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到 克固体。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列关于0.2 mol·L-1 Ba(NO3)2溶液的说法不正确的是 ( )。
A.2 L溶液中阴、阳离子总数为0.8NA
B.500 mL溶液中NO3-浓度为0.4 mol·L-1
C.500 mL溶液中Ba2+浓度为0.2 mol·L-1
D.500 mL溶液中NO3-总数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-1-2物质的分离和提纯练习卷(解析版) 题型:选择题
下述实验不能达到预期目的的是 ( )。
编号实验内容实验目的
A将含有HCl杂质的CO2通入饱和Na2CO3溶液中除去CO2中的HCl
B将一定量的KNO3和NaCl的混合液加热并浓缩至有晶体析出,趁热过滤分离出NaCl晶体
C在含有少量FeCl3的MgCl2酸性溶液中加入足量MgO并过滤除去溶液中的FeCl3
D在含有少量Na2S的NaCl溶液中加入AgCl,再过滤除去溶液中的Na2S
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(一)(解析版) 题型:实验题
某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
物质 | 颜色、性质 | 物质 | 颜色、性质 |
氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
Ⅱ.探究实验:
(1)提出假设
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为__________________________。
(2)实验验证
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物,

①实验前,检查装置A气密性的方法是_______________________________。
②实验时,各装置从左至右的连接顺序为A→________→________→B→________→________。
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O________(填“是”或“否”),理由是________________________________________________________;
②装置________(填上图中装置编号)中________的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式___________________________ _。
(4)问题讨论
①电解CuCl2溶液后的阴极上发生的反应为:______________________
和_______________________________________________________________;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com