
一定温度时,在容积一定的密闭容器中,反应A(?)+B(g)  C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是 (填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是 。
(2)能判断该反应一定达到平衡状态的依据是 。(填写字母编号)
A.体积分数组成C%=D%
B.单位时间内生成n molA的同时生成n molC
C.温度和体积一定时,某一生成物浓度不再变化
D.温度和体积一定时,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如图所示。t2时改了某种条件,改变的条件是 。(填写字母编号)

A.升温 B.加压 C.催化剂 D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是 。
(1)吸热 K=[ c(C)·c(D)]/ c(B) (2)BCD (3)B(4)40%
【解析】
试题分析: (1)容积固定,升高温度,密度增大,说明气体质量增大,所以A为非气体。且正反应是放热反应。A为非气态,不列入平衡常数表达式。
(2)每生成1molC同时生成1molD,无论是平衡状态还是非平衡状态,C和D体积分数均相等,A错误;生成A和生成C分别为逆反应和正反应,且正、逆反应速率相等,是平衡状态,B正确;某一组分浓度不变说明是平衡状态,C正确;因A是非气态,反应前后气体物质的量变化,所以温度和体积一定时,气体压强不变的状态是平衡状态,D正确。
(3)新旧平衡不连续,不可能是改变浓度,D错误;催化剂对平衡移动无影响,C错误;t2后逆反应速率大于正反应速率,说明平衡向逆反应方向移动。因该反应是吸热反应,升高温度,平衡向右移动,A错误;A是非气态,增大压强,平衡向左移动,B正确。
(4)扩大容器体积等效于减小压强,由A的百分含量不变说明此条件下A是气体。设转化的B物质的量为x,K=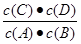 =
=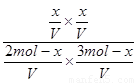 =1,解得x=1.2mol。B的转化率为0.4。
=1,解得x=1.2mol。B的转化率为0.4。
考点: 勒沙特列原理 化学平衡状态的标志 化学平衡常数 转化率


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g)
一定温度下,在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g)
| ||
| x2V |
| n(1-x)3 |
| x2V |
| n(1-x)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A、反应在前5min的平均速率为v(SO2)=0.08mol?L-1 min-1 |
| B、保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v(正)>v(逆) |
| C、保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
| D、相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省德阳市高三“一诊”考试化学试卷(解析版) 题型:填空题
(10分)一定温度时,在容积一定的密闭容器中,反应A(s)+B(g) C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是 (填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是 。
(2)能判断该反应一定达到平衡状态的依据是 。(填写字母编号)
A. 体积分数组成C%=D%
B. 单位时间内生成n moAl的同时生成n molC
C. 温度和体积一定是,某一生成物浓度不再变化
D. 温度和体积一定是,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如右图所示。

T2时改变了某种条件,改变的条件是 。(填写字母编号)
A.升温 B.加压 C.催化剂 D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com