
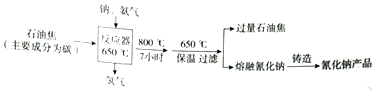

 .
.分析 (1)由流程图可知钠、C、氨气合成生成NaCN,同时生成氢气;
(2)氰化钠有毒,为剧毒品;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键;
(4)等物质的量的NaCN和HCN的混合溶液,其pH>7,说明CN-的水解程度大于氢氰酸的电离程度,导致溶液呈碱性,根据电荷守恒知,钠离子和氢氰根离子浓度的关系,据此分析;根据Kb=$\frac{Kw}{Ka}$计算;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,根据氧化还原反应配平;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子;ClO-可将CN-氧化为N2和CO32-,据此书写.
解答 解:(1)由流程图可知钠、C、氨气合成生成NaCN,同时生成氢气,反应为:2Na+2C+2NH3$\frac{\underline{\;650℃\;}}{\;}$2NaCN+3H2;
故答案为:2Na+2C+2NH3$\frac{\underline{\;650℃\;}}{\;}$2NaCN+3H2;
(2)氰化钠有毒,为剧毒品,选择标签B;
故答案为:B;
(3)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,钠离子与CN-形成离子键,电子式为: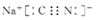 ;
;
故答案为: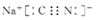 ;
;
(4)含等物质的量的NaCN和HCN的混合溶液,其pH>7,
A.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),错误;
B.pH>7,溶液C(OH-)>C(H+),呈碱性,说明CN-的水解程度大于氢氰酸的电离程度,c(CN-)<c(HCN),正确;
C.根据物料守恒:2c(Na+)=c(CN-)+c(HCN),根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),联合得:2c(H+)=2c(OH-)+c(CN-)-c(HCN),错误;
D.根据电荷守恒知,C(OH-)+c(CN-)=C(H+)+C(Na+),则c(Na+)-c(CN-)=c(OH-)-C(H+),正确;NaCN属于强碱弱酸盐,在溶液中水解显碱性,其水解的离子方程式为:CN-+H2O?HCN+OH-;Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{4.9×1{0}^{-10}}$≈2.0×l0-5;
故答案为:BD;2.0×10-5;
(5)根据题意可知,双氧水与氰化钠反应生成NH3、NaHCO3,其反应的方程式为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=MaHCO3+NH3↑;
(6)阳极为氯离子发生氧化反应生成次氯酸根离子,反应式为:Cl-+2OH--2e-=ClO-+H2O;ClO-可将CN-氧化为N2和CO32-,反应为:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O;
故答案为:Cl-+2OH--2e-=ClO-+H2O;2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O.
点评 本题以物质制备为载体,主要考查了化学方程式的书写、氧化还原反应、环境保护、溶液中离子浓度的比较、电解池的原理、弱电解质的电离平衡、水解平衡等,注意电离平衡常数的应用,结合电荷守恒来分析解答,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 相对分 子质量 | 溶解度 | |||
| 冷水 | 热水 | 乙醇 | 乙醚 | |||
| 呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
| 呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
| 呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
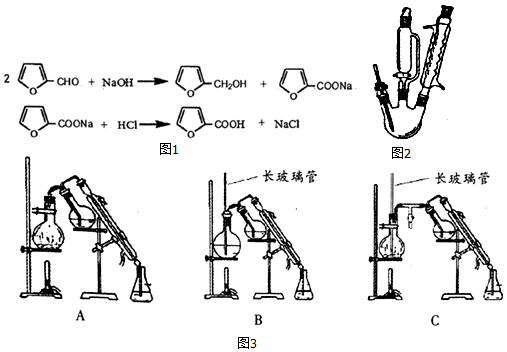
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
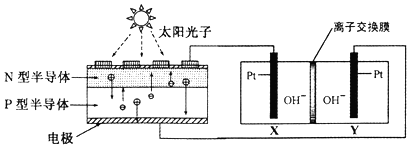
| A. | 图中N型半导体为负极,P型半导体为正极 | |
| B. | 图中离子交换膜为阴离子交换膜 | |
| C. | 反应完毕,该装置中电解质溶液的碱性增强 | |
| D. | 人体呼出的气体参与X电极的反应:CO2+2e一+H2O=CO+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的热稳定性:H2T<H2R | |
| B. | 单质与稀盐酸反应的速率:L<Q | |
| C. | 离子半径:R2-<L2+ | |
| D. | M与T形成的化合物既能与强酸反应,又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | mg该磁黄铁矿中含+2价的铁0.75mol | |
| B. | 200mL盐酸中HCl物质的量浓度为4.25mol•L-1 | |
| C. | 生成的H2S气体在标准状况下的体积为16.8L | |
| D. | 该磁黄铁矿中Fe1-nS的n=0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com