
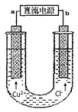
| A. | a端是直流电源的负极 | |
| B. | 通电使CuCl2发生电离 | |
| C. | 阴极上发生的反应:Cu2++2e-=Cu | |
| D. | 通电后,在阳极附近可观察到黄绿色气体 |
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | X | R | T | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.078 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 | +5、-3 |
| A. | 简单氢化物的沸点:X>T>Q | |
| B. | 离子半径:X2->T2->L2+>M3+ | |
| C. | 工业上用电解熔融状态的L和T的化合物制取单质L | |
| D. | L、M的最高价氧化物对应的水化物既能与强碱反应又能与强酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为混合物,煤中含有苯等有机物 | |
| B. | 石油裂化和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 | |
| C. | 石油的裂解主要目的是提高汽油的产量和质量 | |
| D. | 汽油燃烧产生的汽车尾气中,所含的大气污染物主要是碳氮的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜长期放置在潮湿的空气中容易生锈,生成Cu(OH)2 | |
| B. | 铜丝在氯气中燃烧生成CuCl2而与硫反应生成Cu2S,说明氧化性Cl2>S | |
| C. | CuO不及Cu2O稳定,高温条件下CuO可以分解生成Cu2O和氧气 | |
| D. | 蓝色的CuSO4•5H2O可以受热分解转化为白色的CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
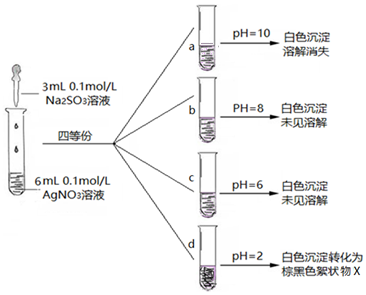
| 实验 | 操作 | 现象 |
| ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
| ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
| ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3)2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| X | 单质不能将比它不活泼的金属从其盐溶液中置换出来 |
| Y | 第三周期原子半径最小的金属 |
| Z | 单质是淡黄色固体 |
| A. | R的最高价氧化物既能与某种非金属单质反应,又能与某种金属单质反应 | |
| B. | X、Y、Z的氧化物分别投入NaOH溶液中一定都能发生反应 | |
| C. | X、Y、Z的原子半径依次减小,离子半径依次增大 | |
| D. | X、Y、Z的最高价氧化物对应水化物之间可以两两反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com