
实验室用KMnO4与密度为1.19g•cm﹣3,溶质质量分数为36.5%的HCl溶液反应制取氯气,反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥法分析电子转移的方向和数目(直接在上述方程式中表示).
(2)若反应中有0.5mol电子转移,被氧化的HCl的物质的量是 mol;
(3)c(HCl)= ;
(4)取上述盐酸0.1L与15.8gKMnO4充分反应,生成标况下的Cl2的体积V(Cl2)= L.
考点: 氧化还原反应的计算;氧化还原反应的电子转移数目计算.
分析: (1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,根据Mn元素的化合价+7→+2,Cl元素的化合价﹣1→0,标出电子的转移方向和数目;
(2)根据方程式确定被氧化的HCl的物质的量和转移电子之间的关系;
(3)根据公式c=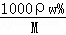 计算盐酸的物质的量浓度;
计算盐酸的物质的量浓度;
(4)根据化学方程式,利用反应判断盐酸和高锰酸钾哪一者的量不足,按照量少的物质计算生成的氯气的体积.
解答: 解:(1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价﹣1→0,反应中氧化剂和还原剂得失电子数目相等,
即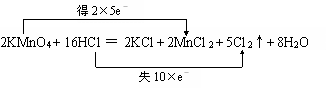 ,答:双线桥法标出反应中电子得失数目为:
,答:双线桥法标出反应中电子得失数目为: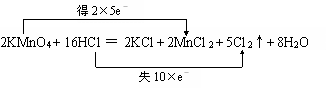 .
.
(2)根据反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,若反应中有10mol电子转移,被氧化的HCl的物质的量是10mol,所以若反应中有0.5mol电子转移,被氧化的HCl的物质的量是0.5mol,故答案为:0.5;
(3)c(HCl)=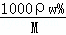 =
=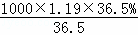 =11.9(mol•L﹣1),
=11.9(mol•L﹣1),
故答案为:11.9mol•L﹣1;
(4)取上述盐酸0.1L,则HCl的物质的量是0.1L×11.9mol/L=1.19mol,与15.8gKMnO4即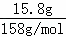 =0.1mol反应,则高锰酸钾全部反应,盐酸剩余,生成氯气是0.25mol,体积是0.25mol×22.4L/mol=5.6L.
=0.1mol反应,则高锰酸钾全部反应,盐酸剩余,生成氯气是0.25mol,体积是0.25mol×22.4L/mol=5.6L.
故答案为:5.6.
点评: 本题考查化学方程式的有关计算,题目难度不大,本题注意有关计算公式的利用,以及电子转移的方向和数目的双线桥标出法.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
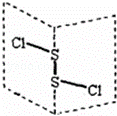
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
|
| A. | S2Cl2的结构式为Cl﹣S﹣S﹣Cl |
|
| B. | S2Cl2为含有极性键和非极性键的极性分子 |
|
| C. | S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2 |
|
| D. | S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
在1﹣18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:

(1)画出D的原子结构示意图;
(2)写出C的最高价氧化物的电子式 ,该化合物所含化学键为共价键;
(3)E和F分别形成的气态氢化物中最稳定的是 (填写氢化物的化学式);
(4)A最高价氧化物的水化物的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
离子方程式:RO3n﹣+3S2﹣+6H+═R﹣+3S↓+3H2O.由此可知在RO3n﹣中,元素R的化合价是()
A. +4 B. +5 C. +6 D. +7
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列两组物质:①H2、CaCO3、HCl、NH3
②氯化钠溶液、硫酸铜溶液、氢氧化铁胶体、硫酸铁溶液
(1)请你从组成的元素、物质的性质等多个角度用两种不同的分类标准从每组中选出一种不同类的物质,并指出其分类依据,写在下面相应的表格内.
组别 分类标准 不属于该类别的物质
第①组
第②组
(2)将第①组某物质的溶液逐滴滴入分别盛有第②组物质的4支试管中,观察到只有一支试管中有明显的现象.这种现象是 ,写出此过程发生反应的离子方程式 .该反应 (“是”或“不是”)氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碱金属铷(Rb)的叙述正确的是()
A. 它位于周期表的第四周期第IA族
B. 氢氧化铷是弱碱
C. 在钠、钾、铷三种单质中,铷的熔点最高
D. 硝酸铷是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是()
A. 食物放在冰箱中会减慢食物变质的速率
B. 钾的金属性强,所以钾与水的反应比钠的反应剧烈
C. 2 mol SO2与1 mol O2混合后充分反应生成2 mol SO3
D. 面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com