
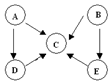
 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.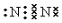 ,D的结构式:
,D的结构式: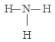 .
.分析 (1)B为红棕色,应为NO2,根据框图转化,可以找到满足条件的物质分别是:A:N2,B:NO2,C:NO,D:NH3,E:HNO3,以此解答该题;
(2)D→C为氨气的催化氧化,生成一氧化氮和水;E→B为硝酸转化为二氧化氮,可以为铜和浓硝酸的反应;A→D为工业合成氨原理;D为氨气溶液呈碱性为氨气和水反应生成一水合氨的电离出氢氧根离子.
解答 解:B为红棕色,应为NO2,根据NO2的性质可知NO2反应能分别生成NO和HNO3,则C应为NO,E为HNO3,NO2可与水反应生成NO,稀HNO3可与Cu反应生成NO,含N元素物质中能生成NO的还有N2和NH3,其中N2和氢气反应还可生成NH3,则分别是:A:N2,B:NO2,C:NO,D:NH3,E:HNO3.
(1)由以上分析可知A:N2,氮气分子中存在氮氮三键,电子式: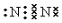 ,B:NO2,D:NH3,氨气中存在3个氮氢键,氨气的结构式为:
,B:NO2,D:NH3,氨气中存在3个氮氢键,氨气的结构式为: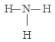 ,
,
故答案为:NO2;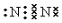 ;
;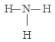 ;
;
(2)D→C为氨气的催化氧化,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,E→B为硝酸转化为二氧化氮,可以为铜和浓硝酸的反应,离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,A→D为工业合成氨原理,化学方程式为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,D为氨气溶液呈碱性为氨气和水反应生成一水合氨的电离出氢氧根离子,发生NH3+H2O?NH3•H2O?NH4++OH-,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O; Cu+4H++2NO3-=Cu2++2NO2↑+2H2O; N2+3H2$?_{催化剂}^{高温高压}$2NH3;NH3+H2O?NH3•H2O?NH4++OH-.
点评 本题考查框图推断,题目难度中等,解题的关键是在审题的基础上找准解题的突破口,经过分析,归纳,推理,得出正确的答案.


科目:高中化学 来源: 题型:选择题
| A. | 500mL0.1mol•L-1的Al2(SO4)3溶液中,含Al3+0.1NA | |
| B. | 36g重氧(18O2)气体所含分子数为NA,占体积为22.4L | |
| C. | 7.8gNa2O2与足量CO2反应,转移电子数为0.1NA | |
| D. | 15g甲基中含有的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
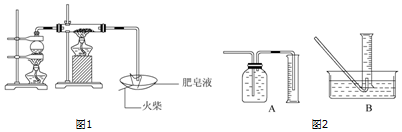
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “神州11号”用Na2O2作氧气的来源,是因为Na2O2能氧化CO2和水产生O2 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作,是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 氨常用作制冷剂利用了氨的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
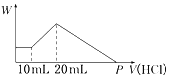 医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
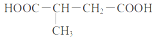
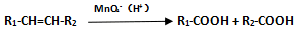
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质且能溶于浓硝酸 |
| C | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小体积使压强增大 | B. | 增大体积使压强减小 | ||
| C. | 体积不变充入H2使压强增大 | D. | 压强不变充入N2使体积增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com