
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
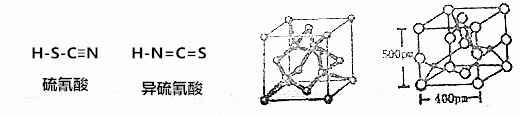
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O2-的结构示意图: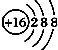 | |
| B. | NH4Br的电子式: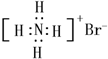 | |
| C. | CCl4的结构式 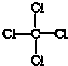 | |
| D. | 氧元素基态原子的电子排布式:1s22s12p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
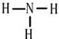
| I1 | I2 | I3 | I4 | I5 | I6 | |
| In | 578 | 1817 | 2745 | 11578 | 14831 | 18378 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:HF>HCl>HBr>HI | |
| B. | 稳定性:HF<HCl<HBr<HI | |
| C. | 从F2到I2,颜色逐渐加深 | |
| D. | 与氢气化合由易到难:I2>Br2>Cl2>F2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| B. | 煤炭燃烧前经过脱硫处理可减少酸雨的产生 | |
| C. | 燃料电池是一种高效、友好的发电装置,可将化学能完全转化为电能 | |
| D. | 太阳能的利用,一般是将太阳辐射能先转化为热能、电能或化学能,再加以利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- | |
| B. | 含有大量AlO2-的溶液中:Na+、K+、HCO3-、NO3- | |
| C. | 中性溶液中:K+、Fe3+、Cl-、SO42- | |
| D. | Na2S溶液中:SO42-、K+、Cu2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=2b<0 | B. | a=2c<0 | C. | c=2d>0 | D. | c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
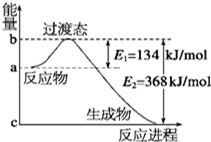 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)CO2(g)+NO(g)△H=-234kJ/mol.
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)CO2(g)+NO(g)△H=-234kJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com