
| A. | 元素非金属性按X、Y、Z的顺序增强 | |
| B. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| C. | 气态氢化物的稳定性按X、Y、Z的顺序增强 | |
| D. | 单质的氧化性按X、Y、Z的顺序减弱 |
分析 由同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性顺序是HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,以此来解答.
解答 解:由同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性顺序是HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,
A.由HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,则非金属性按X、Y、Z的顺序依次减弱,故A错误;
B.非金属性越强,对应阴离子的还原性越弱,则阴离子的还原性按照X、Y、Z的顺序逐渐增强,故B错误;
C.非金属性越强,气态氢化物越稳定,则态氢化物的稳定性按照X、Y、Z的顺序逐渐减弱,故C错误;
D.非金属性越强,单质的氧化性越强,则单质的氧化性按照X、Y、Z的顺序逐渐减弱,故D正确.
故选D.
点评 本题考查同周期元素的非金属,明确非金属比较的常见方法是解答的关键,学生应注重对规律性知识的归纳.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 低温下是自发变化 | B. | 高温下是自发变化 | ||
| C. | 任何温度下都是自发变化 | D. | 任何温度下都是非自发变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨与1mol金刚石完全燃烧放出的能量同样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氯乙烷的结构式CH3Cl | |
| B. | 丁烷的结构简式CH3(CH2)2CH3 | |
| C. | 氯化氢分子的形成过程可用电子式表示为: | |
| D. | 四氯化碳的电子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)如图所示的原电池装置,Cu电极反应式为2H++2e-=H2↑;当导线上通过2.408×1022个电子时,锌片质量减少1.3g.
(1)如图所示的原电池装置,Cu电极反应式为2H++2e-=H2↑;当导线上通过2.408×1022个电子时,锌片质量减少1.3g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水久置后pH增大 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | 可用澄清石灰水除去CO2中混有的少量SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
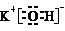 ;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.
;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯都能使酸性KMnO4溶液褪色 | |
| B. | 等质量的乙烯与聚乙烯完全燃烧,产生的CO2质量相等 | |
| C. | 乙醇和乙醚(CH3CH2OCH2CH3)互为同分异构体 | |
| D. | 乙炔与苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
| 苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
| 硼氢化钠 | - | - | 1.076 | 溶 | 溶 | 不溶 |
| 乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com