
| A. | C2H2 | B. | C2H4 | C. | C3H8 | D. | C2H6 |
分析 设烃的分子式为CxHy,燃烧的化学方程式为:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,120℃时水为气体,恢复到原状态,测得反应后混合气体的体积与原体积相等,即反应前后气体的化学计量数不变,据此计算判断.
解答 解:设烃的分子式为CxHy,燃烧的化学方程式为CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,
120℃时水为气体,恢复到原状态,测得反应后混合气体的体积与原体积相等,即反应前后气体的化学计量数不变,
则:1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,
解得:y=4,
即混合烃中的平均H原子数目为4,
由于甲烷分子中含有4个H原子,则另一种烃分子中一定含有4个H,选项中只有B符合,
故选B.
点评 本题考查有机物分子式确定的计算,注意根据有机物燃烧的方程式进行计算,明确平均值法在有机物分子式确定中的应用方法.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
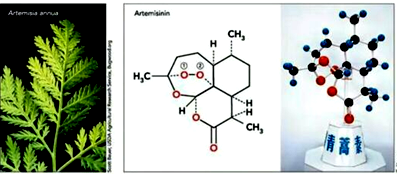
| A. | 青蒿素极易溶于水 | |
| B. | 1 mol青蒿素与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 青蒿素含有过氧键,有较强氧化性 | |
| D. | 青蒿素分子式为C15H21O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
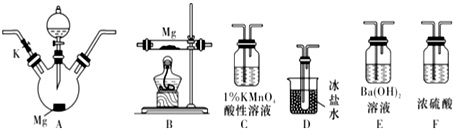
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 每消耗0.1molNH4HCO3放出2.24L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在体积和温度不变的条件下,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| B. | m:n:w=3:1:2 | |
| C. | 单位时间内反应物浓度的减少等于生成物浓度的增加 | |
| D. | 在体积和温度不变的条件下,若在前10 s内A减少了xmol,则在同条件下,前20 s减少小于2x mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
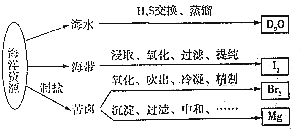
| A. | 从海水中提取D2O是化学变化 | |
| B. | 从海带中提取I2时可用乙醇进行萃取 | |
| C. | 实验室用带玻璃塞的棕色试剂瓶贮存液溴 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12LCO2气体通入1L0.1mol/l的NaAlO2溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
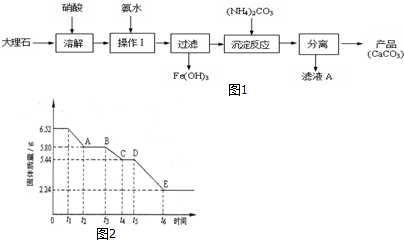
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com