
| A. | 4句 | B. | 5句 | C. | 6句 | D. | 7句 |
分析 强弱电解质的根本区别是电离程度,完全电离的电解质是强电解质,部分电离的电解质是弱电解质,只要能证明HA部分电离就能证明HA是弱电解质,据此分析解答.
解答 解:①常温时NaA溶液的pH大于7,说明NaA是强碱弱酸盐,则HA是弱酸,部分电离,为弱电解质,故正确;
②用HA溶液做导电实验,灯泡很暗,说明该溶液中离子浓度很小,但不能说明HA部分电离,所以不能证明HA是弱电解质,故错误;
③HA与NaCl不能反应,说明和NaCl不具备复分解反应的条件,但不能说明HA部分电离,为弱电解质,故错误;
④常温下0.1mol•L-1的HA溶液pH=2,氢离子浓度小于HA浓度,说明HA部分电离,为弱电解质,故正确;
⑤1L pH=1的HA溶液加水稀释至100mL后溶液的pH=2.2,说明HA中存在电离平衡,为弱电解质,故正确;
⑥1L pH=1的HA溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HA消耗的NaOH多,说明HA中存在电离平衡,为弱电解质,故正确;
⑦HA溶液中加水稀释,溶液中c(OH-)增大,只能说明HA为酸,不能说明HA部分电离,所以不能说明HA是弱电解质,故错误;
故选A.
点评 本题考查强弱电解质判断,为高频考点,明确强弱电解质根本区别是解本题关键,注意不能根据溶液导电性强弱、电解质溶解性强弱判断电解质强弱,为易错题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 1mol分枝酸最多可与3mol NaOH发生中和反应 | |
| C. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 | |
| D. | 分枝酸分子中含有2种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | SiO2与酸、碱均能反应,属于两性氧化物 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
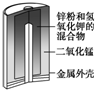 |  | 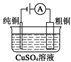 | 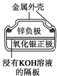 |
| 图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
| A. | 图Ⅰ所示电池中,MnO2的作用是催化剂 | |
| B. | 图Ⅱ所示电池充电过程中,阳极的反应为:PbSO4+2H2O+2e-═PbO2+SO42-+4H+ | |
| C. | 图Ⅲ所示装置工作过程中,若阳极质量减少6.4 g,则电路中转移电子数为0.2×6.02×1023 | |
| D. | 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 解释 | |
| A | 常温下,用pH计测定NaHCO3溶液的pH | pH=8.5 | HCO3-的水解程度大于电离程度 |
| B | 向一定量的浓硫酸中加入过量的锌粒,微热至反应结束 | 产生气泡 | 该气体为SO2 |
| C | 往盛有少量水的两支试管中分别加入Na和Na2O2 | 固体溶解,产生气泡 | 两个反应中水都作氧化剂 |
| D | 往盛有AlCl3溶液中滴加氨水至过量 | 产生白色沉淀,后溶解 | Al(OH)3具有两性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
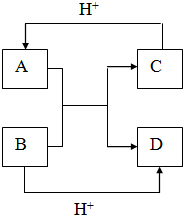 写出下列微粒的化学式
写出下列微粒的化学式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com