
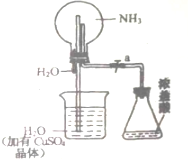
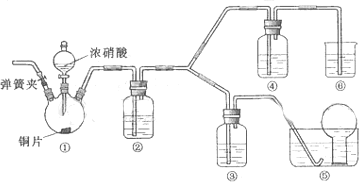
 如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.
如图,室温下,挤压胶头滴管.待现象发生时,再打开活塞a,烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,有关的化学方程式是NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O. 分析 挤压胶头滴管,氨气与水反应生成一水合氨,压强平衡被破坏,则烧杯中硫酸铜溶液上升,形成蓝色喷泉,然后与氨气反应生成蓝色沉淀,再打开活塞a,浓盐酸挥发进入烧瓶中,沉淀溶解,以此来解答.
解答 解:挤压胶头滴管,氨气与水反应生成一水合氨,压强平衡被破坏,则烧杯中硫酸铜溶液上升,形成蓝色喷泉,然后与氨气反应生成蓝色沉淀,再打开活塞a,浓盐酸挥发进入烧瓶中,沉淀溶解,则烧瓶中能观察到的现象是先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液,发生的反应为NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O,
故答案为:先形成蓝色喷泉,然后有蓝色沉淀生成后溶解变为蓝色溶液;NH3+H2O=NH3.H2O、CuSO4+2NH3.H2O=Cu(OH)2↓+(NH4)2SO4、Cu(OH)2+2HCl=CuCl2+H2O.
点评 本题考查实验装置的综合应用,为高频考点,把握氨气的性质、喷泉实验原理、发生的反应为解答的关键,侧重分析与实验能力的考查,注意实验与元素化合物知识的结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑧ | B. | ②③④ | C. | ①④⑥ | D. | ④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.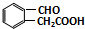 或
或 (任写一种).
(任写一种).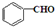 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
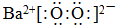 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析以滤纸作为惰性支持物 | |
| B. | 应沿试管壁小心地将展开剂慢慢倒入试管底部 | |
| C. | 纸层析的实质是试样中的各组分在两相之间产生不同分配 | |
| D. | 点样后的滤纸需晾干后,才能将其浸入展开剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有一种蓝色晶体【可表示为MxFey(CN)6】,经射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,其晶体中阴离子的最小结构单元如图所示,下列说法正确的是( )
有一种蓝色晶体【可表示为MxFey(CN)6】,经射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,其晶体中阴离子的最小结构单元如图所示,下列说法正确的是( )| A. | 该晶体的化学式为M2Fe2(CN)6 | |
| B. | 该晶体属于离子晶体,M呈+1价 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为3个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 向某恒容密闭容器中通入1mol SO2和0.5 molO2,达到平衡时放出热量为98.5 kJ | |
| C. | 升高温度能使逆反应速率加快,正反应速率减慢 | |
| D. | 向某恒容密闭容器中通入一定量的SO2和O2达到平衡后,再通入少量气体He,平衡不移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com