
| A��Ũ�Ⱦ�Ϊ0.02 mol?L-1��AgNO3��CH3COONa��Һ���һ������CH3COOAg���� |
| B����0.1 mol/LAgNO3��Һ��μ��뵽0.001mol/LKCl��0.001mol/LK2S��Һ�У��Ȳ���AgCl���� |
| C��ҪʹMg2+Ũ��Ϊ0.12 mol?L-1����Һ�в���Mg��OH��2�ij�������Һ��pH��9 |
| D����0.1mol/L AgNO3��Һ�еμ�0.1mol/LNaCl��Һ�������а�ɫ�������ɣ��������еμ�0.1mol/L��Na2S��Һ����ɫ����ת��Ϊ��ɫ�������������ӷ���ʽΪ��2Ag++S2-��aq��?Ag2S��s�� |
|


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | �����Ϣ |
| X | X�ǵؿ��к�������Ԫ�� |
| Y | YԪ��ԭ�Ӻ���3p�ܼ�����4������ |
| Z | ����Z��������Ϊ14��������Ϊ7 |
| T | T�ĵ�����һ�ֳ����Ľ����������Ƶ�������������Һ�����ڼ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
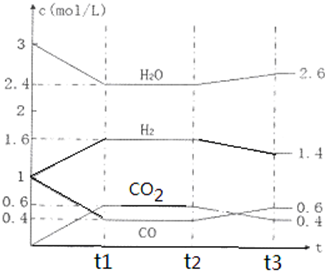

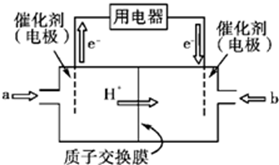
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
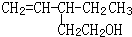 ����һ���Ĺ�ѧ���ԣ������о�����ʹ������ʧȥ��ѧ���Եķ���
����һ���Ĺ�ѧ���ԣ������о�����ʹ������ʧȥ��ѧ���Եķ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��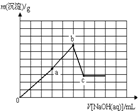 |
B��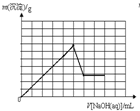 |
C��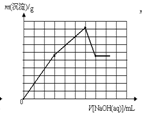 |
D��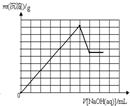 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�������£�AgCl��Ҫ��NaI��Һ�п�ʼת��ΪAgI����NaI��Ũ�ȱ��벻����
| ||||
| B�����ֲ������Ksp���Խ�������Խ����ת��Ϊ�����ܵIJ����� | ||||
| C��AgI��AgCl��������ˮ������AgCl����ת��ΪAgI | ||||
| D��AgCl������ˮ������ת��ΪAgI |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ֻ��AgBr�������� |
| B��AgCl��AgBr������������ |
| C��AgCl��������AgBr���� |
| D��AgCl��������AgBr���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
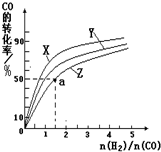 ̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ�����룬����һ��ֵ���ڴ����µ����ʽ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʣ�
̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ�����룬����һ��ֵ���ڴ����µ����ʽ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʣ�| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com