
【题目】某化学兴趣小组探究氯与水反应的热效应及所得溶液氯元素含量,查阅大量资料并做下列实验探究验证
实验Ⅰ:在通风橱内向装有80mL蒸馏水的锥形瓶![]() 瓶口塞上棉花团
瓶口塞上棉花团![]() 中鼓入氯气,至溶液中pH没有明显变化停止通入氯气,使用数据采集器,测定在此过程中溶液的温度及pH变化,具体数据如图所示:
中鼓入氯气,至溶液中pH没有明显变化停止通入氯气,使用数据采集器,测定在此过程中溶液的温度及pH变化,具体数据如图所示:
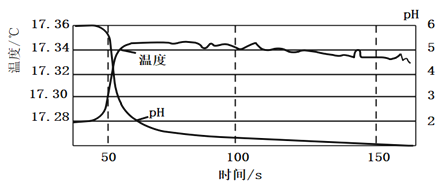
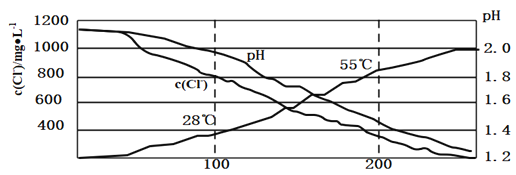
实验Ⅱ:对20mL饱和氯水加热,测出c(Cl—)、pH及温度变化如图2所示。
实验Ⅲ:采用莫尔法测定氯水中氯元素的含量。此法是以![]() 为指示剂,用
为指示剂,用![]() 标准溶液进行滴定。其实验步骤如下:
标准溶液进行滴定。其实验步骤如下:
①准确移取25.00ml氯水试样3份,分别置于锥形瓶中,再分别加入25.00ml水;
②向试样中加入足量的![]() 溶液;
溶液;
③除去过量的![]() ,冷却;
,冷却;
④调整溶液的pH,再加入![]()
![]() 溶液,在不断摇动下用
溶液,在不断摇动下用![]()
![]()
![]() 标准溶液滴定至溶液呈砖红色
标准溶液滴定至溶液呈砖红色![]()
![]() 砖红色
砖红色![]() ]
]
⑤重复上述实验,测得消耗![]() 标准溶液体积的平均值为vmL
标准溶液体积的平均值为vmL
回答下列问题:
(1)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。该反应的离子方程式为______;估算该离子反应的平衡常数______
(2)根据实验Ⅰ测定结果判断氯气与水的反应是______![]() 填“吸热反应”或“放热反应”
填“吸热反应”或“放热反应”![]() 理由是______
理由是______
(2)分析实验Ⅱ图,小组同学推测产生该结果的原因可能是多种反应造成的,下列叙述合理的是______
A.升温,氯气挥发导致c(Cl—)减小
B.对于![]() 和
和![]() 的反应,升温平衡逆向移动,c(Cl—)减小,pH减小
的反应,升温平衡逆向移动,c(Cl—)减小,pH减小
C.升温,促进次氯酸分解2HClO![]() 2HCl+O2↑
2HCl+O2↑
D.升温,可能发生3HClO![]() 2HCl+HClO3(强酸) ,使得pH减小
2HCl+HClO3(强酸) ,使得pH减小
(4)实验Ⅲ步骤3中加足量的![]() 溶液,目的是______
溶液,目的是______
(5)用![]() 标准溶液滴定氯离子达到化学计量点时,
标准溶液滴定氯离子达到化学计量点时,![]() ,若此时要求不生成
,若此时要求不生成![]() 沉淀,则
沉淀,则![]() 最大不能超过______
最大不能超过______![]() 已知:
已知:![]() ,
,![]()
(6)计算实验Ⅲ氯水中氯元素的含量,列出算式:______![]()
【答案】![]()
![]() 放热反应 随氯气通入,溶液温度升高 ACD 足量的过氧化氢可将氯气完全还原为氯离子
放热反应 随氯气通入,溶液温度升高 ACD 足量的过氧化氢可将氯气完全还原为氯离子 ![]()
![]()
【解析】
(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:![]() ,在1L水中可溶解
,在1L水中可溶解![]() 氯气,氯气浓度近似为
氯气,氯气浓度近似为![]() ,则可建立如下三段式:
,则可建立如下三段式:

则平衡常数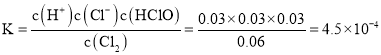 ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)由图可知,随氯气通入,发生反应使溶液温度升高,则正反应为放热反应,故答案为:放热;随氯气通入,溶液温度升高;
(3)A.升高温度、气体的溶解度减小,则导致![]() 减小,故A正确;
减小,故A正确;
B.为放热反应,升高温度平衡逆向移动,![]() 减小,而pH增大,故B错误;
减小,而pH增大,故B错误;
C.HClO不稳定,受热易分解,升温,促进次氯酸分解,故C正确;
D.升温,可能发生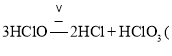 强酸
强酸![]() ,酸性增强,则pH减小,故D正确;故答案为:ACD;
,酸性增强,则pH减小,故D正确;故答案为:ACD;
(4)实验Ⅲ步骤3中加足量的![]() 溶液,目的是足量的过氧化氢可将氯气完全还原为氯离子,故答案为:足量的过氧化氢可将氯气完全还原为氯离子;
溶液,目的是足量的过氧化氢可将氯气完全还原为氯离子,故答案为:足量的过氧化氢可将氯气完全还原为氯离子;
(5)用![]() 标准溶液滴定氯离子达到化学计量点时,
标准溶液滴定氯离子达到化学计量点时,![]() ,不生成
,不生成![]() 沉淀,则
沉淀,则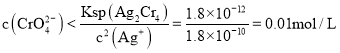 ,故答案为:
,故答案为:![]() ;
;
(6)由![]() 可知,实验Ⅲ氯水中氯元素的含量为
可知,实验Ⅲ氯水中氯元素的含量为![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】世界上最早发现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载。回答下列问题:
(1)基态Zn原子的核外电子所占据的最高能层符号为___。
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为_______。
②![]() 中,中心原子的轨道杂化类型为________。
中,中心原子的轨道杂化类型为________。
③写出一种与![]() 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
④NH3极易溶于水,除因为它们都是极性分子外,还因为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的工业加工过程中,可利用CO和H2合成甲醇,能量变化如图所示。下列说法正确的是

A.该反应是吸热反应
B.1molCH3OH所具有的能量为90.1kJ
C.CO(g)+2H2(g)![]() CH3OH(l) ΔH=-90.1kJ·mol-1
CH3OH(l) ΔH=-90.1kJ·mol-1
D.1molCO和2molH2断键所需能量小于1molCH3OH断键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O
请根据要求填写下列空白:
(1)溶液①呈_________性(填“酸”、“碱”或“中”),其原因是_____________(用离子方程式表示)。
(2)在上述五种溶液中,pH最小的是_____;c(NH4+)最小的是____(填序号)。
(3)在溶液④中,_____________离子的浓度为0.1mol/L;NH3H2O和________离子的物质的量浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____________c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为基本原料可制备许多物质,如:
![]()
下列有关说法正确的是( )。
A.淀粉与纤维素互为同分异构体
B.反应⑤是取代反应
C.反应①是氧化反应
D.在加热条件下,可用银氨溶液鉴别葡萄糖和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是
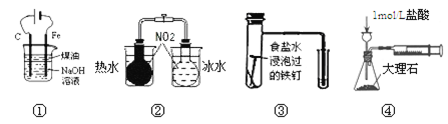
A.用图①装置制备Fe(OH)2并能较长时间观察其颜色
B.用图②装置探究温度对平衡移动的影响
C.用图③装置验证铁发生析氢腐蚀
D.用图④装置测定反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸铵[(NH4)2S2O8]是一种常用的氧化剂和漂白剂。一种以辉铜矿(主要成分为Cu2S,且杂质不参与下列流程中的反应)为原料制备过二硫酸铵的流程如图所示:
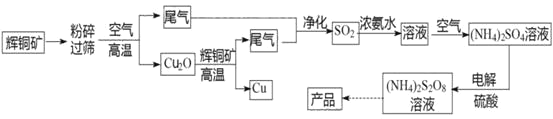
请回答下列问题:
(1)矿石“粉碎”的目的是________
(2)Cu2O和辉铜矿在高温下反应的化学方程式为________。在该反应中,n(氧化剂):n(还原剂)=________。
(3)工业上,常采用电解法制取(NH4)2S2O8,其装置如下图所示。则电解时,阳极的电极反应式为:________。当电路中转移2.5mol电子时,阴极产生________(填数值)mol________(填物质)。
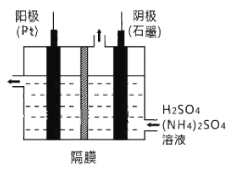
(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、________、________、干燥等操作。
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液中微粒的物质的量浓度关系不正确的是
A.等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(![]() ):①>③>②
):①>③>②
B.等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数
D.向20mL氨水中加入10mL等浓度的盐酸,有c(![]() )-c(NH3H2O)=2[c(OH-)-c(H+)]
)-c(NH3H2O)=2[c(OH-)-c(H+)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为:CH4+2O2+2KOH![]() K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6 L O2,可向外提供2.4×104C的电量
C.通过甲烷电极的电极反应为:CH4+10OH--8e-![]() CO32-+7H2O
CO32-+7H2O
D.放电一段时间后,溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com