
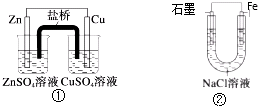
| A. | 装置②中的Fe发生析氢腐蚀 | |
| B. | 装置①中,Zn为负极,发生还原反应 | |
| C. | 装置①中,盐桥中的K+移向CuSO4溶液 | |
| D. | 装置②中电子由Fe流向石墨,然后再经溶液流向Fe |
分析 装置①为原电池,锌比铜活泼,锌为负极,铜为正极,原电池工作时阳离子向正极移动,阴离子向负极移动,装置②为铁的吸氧腐蚀,铁被氧化,为负极,石墨为正极,氧气在正极得到电子,以此解答该题.
解答 解:A.装置②电解质为氯化钠,溶液呈中性,铁发生吸氧腐蚀,故A错误;
B.装置①中,Zn为负极,发生氧化反应,故B错误;
C.装置①为原电池,锌比铜活泼,锌为负极,铜为正极,盐桥中的K+移向CuSO4溶液,即向正极移动,故C正确;
D.电子只能经过外电路,不能经过溶液,故D错误;
故选C.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极的判断和电极方程式的书写,为解答该类题目的关键,难度不大,注意把握原电池的工作原理.


科目:高中化学 来源: 题型:解答题
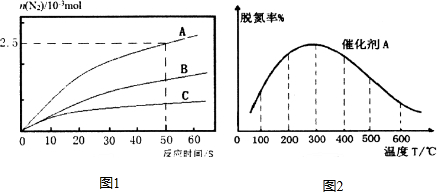 研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.
研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
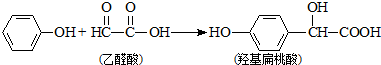
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与2molBr2反应发生加成反应 | |
| C. | 羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
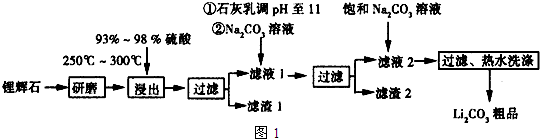
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol Cl2与足量NaOH溶液完全反应,转移的电子数2NA | |
| B. | 常温常压下,11.2 L CO2中含有的分子数是0.5NA | |
| C. | 标准状况下,22.4 L水所含原子数为3NA | |
| D. | 常温常压下,48 g O3和O2的混合气体中氧原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com