
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| B. | 制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| C. | 为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,该方案可行 | |
| D. | 为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出,洗涤,烘干,称重.若烘干时间过长,会导致测定结果偏小 |
分析 A.钠元素焰色反应呈黄色,但溶液中的溶质不一定是钠盐;
B.二氧化氮和水反应生成硝酸和NO;
C.应先把水蒸气排除才合理;
D.烘干时间过长,使剩余物的质量偏大,锌的质量偏小.
解答 解:A.钠元素焰色反应呈黄色,但溶液中的溶质不一定是钠盐,可能是NaOH,故A错误;
B.二氧化氮和水反应生成硝酸和NO,NO不能被水吸收,故B错误;
C.混合物与足量稀硫酸充分反应,也会生成水和二氧化,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,不能测定含量,故C错误;
D.烘干时间过长,使剩余物的质量偏大,锌的质量偏小,则测定结果偏小,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及焰色反应、尾气处理、物质含量测定等知识点,明确实验原理及物质性质是解本题关键,注意C中排除其它因素干扰,为易错点.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | NO不溶于水,是一种大气污染物 | |
| B. | NO是一种红棕色的有毒气体 | |
| C. | NO结合血红蛋白的能力比CO还强 | |
| D. | NO与氧气反应生成NO2,体现其还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.23 g NaCl固体 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 分液以后 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | |
| D. | 粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
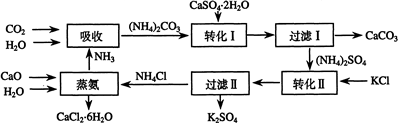
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由C(石墨)=C(金刚石)△H=+11.9 kJ/mol,可知金刚石比石墨稳定 | |
| B. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 | |
| C. | 水力(水能)按不同的分类可看成可再生能源和一级能源 | |
| D. | 可表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu2++2OH-=Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+=CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-=CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-=H2O 2KOH+H2SO4═K2SO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com