
下列化学反应的离子方程式正确的是
A.Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.将过量SO2气体通入氨水中:SO2 + NH3·H2O =NH4++ HSO3-
C.用醋酸除去水垢中的CaCO3 : CaCO3 + 2 H+=Ca2++ H2O+CO2↑
D.用KIO3氧化酸性溶液中的KI: 5I-+IO3- +3H2O=3I2+6OH-
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末化学试卷(解析版) 题型:选择题
镁燃料电池具有比能量高、使用方便、原材料来源丰富、成本低等特点。一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池。其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )

A.镁燃料电池中镁均为负极,发生氧化反应
B.镁次氯酸盐燃料电池的总反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-
C.镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-=2H2O
D.镁次氯酸盐燃料电池放电过程中OH-移向正极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:实验题
某化学课外小组通过实验探究化学反应速率和化学反应限度。
(1)实验一:探究温度和浓度对反应速率的影响
方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘(2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O),生成的碘可用淀粉溶液检验,根据出现蓝色所需的 时间来衡量该反应的速率。
实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
① | 5 | 5 | V1 | 0 | |
② | 5 | 5 | 40 | 25 | |
③ | 5 | V2 | 35 | 25 |
则V1= mL,V2= mL.
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验步骤:
ⅰ.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
①写出KI和FeCl3反应的离子方程式: 。
②步骤ⅲ中,试剂X是 。
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是:
ⅱ中 。
ⅲ中 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:填空题
【物质结构与性质】纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色。
(1)写出基态Cu+的核外电子排布式____________;
(2)如图结构是铜的某氧化物的晶体结构的最小重复单元,则该氧化物的化学式为____________;
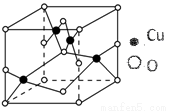
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4•H2O沉淀。
①该沉淀中S原子的杂化类型为____________;
②写出一种与NH3分子互为等电子体的阳离子的化学式____________。
(4)NH3的沸点高于PH3,原因是____________
(5)CuO的熔点比CuCl的熔点____________(填“高”或“低”),其原因是____________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:选择题
常温下,下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol/LCH3COONa溶液与0.1 mol/LCaC12溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl- )
B.将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3·H2O)
C.0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-)
D.0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合:c(Cl-)+c(H+)=c(NH3·H2O)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:选择题
下列有关物质的性质或应用均正确的是
A.二氧化硅为酸性氧化物,可用于制做计算机芯片
B.铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀
C.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
D.浓硫酸具有脱水性,可用于干燥NH3、SO2等
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月模拟四理综化学试卷(解析版) 题型:简答题
以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
(已知:Ksp(MnCO3)=2.2×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38)
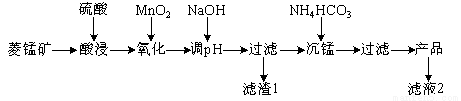
(1)滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
①Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
②“沉锰”前溶液中c(Mn2+)= mol·L-1。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。

①NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
②若溶液中c(Mn2+)=1.0 mol·L-1,加入等体积1.8 mol·L-1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+)= 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月模拟三理综化学试卷(解析版) 题型:选择题
醛或酮与氰化钠、氯化铵反应,生成氨基腈,经水解生成氨基酸盐,是制备氨基酸盐的一种简便方法,反应过程如下:

下列有关该反应说法不合理的是( )
A.反应①是加成反应
B.反应②需要在酸性环境中进行
C.反应②为碱性环境时,产物结构简式是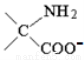
D.经过上述反应,苯乙醛可以制得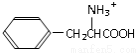
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:选择题
X的分子式为C5H12O,能与金属钠反应产生氢气,X还能与相对分子质量相同的羧酸Y生成酯Z,则有机物Z有(不含立体异构)( )
A.64种 B.16种 C.8种 D.32种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com