
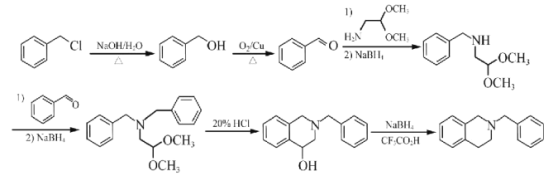
【题目】那可汀是—种药物,该药适用于剌激性干咳病人服用,无成瘾性。化合物I是制备该药物的重要中间体,合成路线如下:
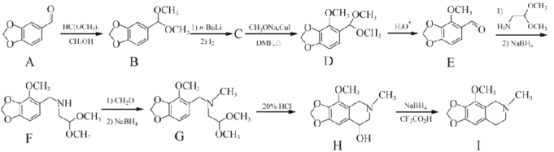
(1)化合物A中的官能团名称为____________(写两种)。
(2)I的分子式为____________。
(3)设计反应A-B的目的为____________。
(4)化合物C的分子式为C10H11O4I,写出C的结构简式:____________。
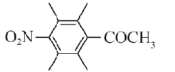
(5)化合物I的—种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________。
①分子中含有硝基(—NO2)且直接连在苯环上;②分子中只有3种不同化学环境的氢。
(6)写出以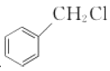 和
和 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
【答案】醚键、醛基 C12H15NO3 防止醛基在后继步骤中反应或保护醛基 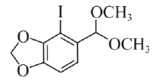
 (只它合理答案也给分)
(只它合理答案也给分)
【解析】
(1)由A的结构可知其含有的官能团有:醛基、醚键,故答案为:醚键、醛基;
(2)根据I的结构简式可知分子式为C12H15NO3,故答案为:C12H15NO3;
(3)A→B转化中醛基被消除,在D→E的转化中又引入醛基,E中醛基参加反应生成F,故A→B的目的是保护醛基,故答案为:防止醛基在后继步骤中反应或保护醛基;
(4)化合物C的分子式为C10H11O4I,对比B、D的结构,可知B中苯环上H原子被I原子取代生成C,C发生取代反应生成D,故C的结构简式为: ,故答案为:
,故答案为: ;
;
(5)化合物I的一种同分异构体同时满足下列条件:①分子中含有硝基(-NO2)且直接连在苯环上;②分子中只有3种不同化学环境的氢,存在对称结构,可以是硝基与-COCH3处于对位,其它位置均连接甲基,符合条件的同分异构体结构式为 ,故答案为:
,故答案为: ;
;
(6)模仿路线中E→I的转化,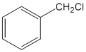 水解生成
水解生成 ,再氧化生成
,再氧化生成![]() ,然后与
,然后与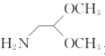 反应生成
反应生成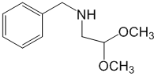 ,生成物与
,生成物与![]() 反应生成
反应生成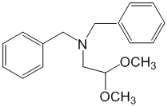 ,然后与盐酸作用生成
,然后与盐酸作用生成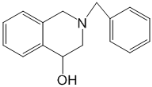 ,最后与NaBH4/CF3CO2H作用得到目标物,合成路线流程图为:
,最后与NaBH4/CF3CO2H作用得到目标物,合成路线流程图为: 。
。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取M g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取50.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取50.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 50.00 | 50.00 | 50.00 | 50.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和_______、________。
(2)操作I为______________,操作Ⅱ为______________。
(3)在方案Ⅱ中滴定终点的判断方法是_______________________________。
(4)在方案Ⅱ中发生的离子反应方程式为____________________________。
(5)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为___________。(写成分数形式)
(6)方案Ⅱ中氧化还原滴定过程中,导致待测液Na2SO3浓度变小的是_____(填序号)。
a.用碱式滴定管量取50mL待测液过程时,开始仰视,滴定结束时俯视
b.用碱式滴定管量取50mL待测液过程时,一开始有气泡,滴定结束后没气泡
c.酸式滴定管用蒸馏水润洗后,没有用酸性KMnO4溶液多次润洗
d.锥形瓶用蒸馏水润洗后,直接装50.00mL的待测液
e.滴定过程时,开始时平视,滴定结束时仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
选项 | 实验目的 | 所选主要仪器 | 部分操作 |
A | 用浓硫酸配制480mL0.1molL-1硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸倒入容量瓶中,加水溶解至刻度线 |
B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、球形冷凝管、锥形瓶、牛角管 | 控制温度分别收集甲醇和甘油 |
D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,请按要求填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________;
(2)写出元素②的最简单氢化物的化学式____________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______________________________________;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法正确的是
A.0.1 L 0.5 mol·L-1 CH3COOH溶液中含有的H+数为0.05NA
B.室温下,稀释0.1 mol·L-1 CH3COOH溶液,溶液的导电能力增强
C.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中所有离子浓度均减小
D.CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的![]() 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是

A.1个Ca2+周围距离最近且等距离的![]() 数目为4
数目为4
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,含碳微粒![]() 、
、![]() 、
、![]() 存在于
存在于![]() 草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数
草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数![]() 某微粒物质的量浓度与三种微粒物质的量浓度和比值
某微粒物质的量浓度与三种微粒物质的量浓度和比值![]() 与溶液pH的关系如图所示,下列有关说法错误的是
与溶液pH的关系如图所示,下列有关说法错误的是![]()
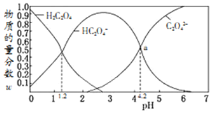
A.向![]() 的溶液中加NaOH溶液将pH增大至
的溶液中加NaOH溶液将pH增大至![]() 的过程中水的电离度一直增大
的过程中水的电离度一直增大
B.![]() 时,溶液中c
时,溶液中c![]()
![]()
![]()
C.![]() 若草酸的第二级电离平衡常数为
若草酸的第二级电离平衡常数为![]() ,则
,则![]()
D.将![]() 相同物质的量浓度
相同物质的量浓度![]() 和
和![]() 的两份溶液等体积混合,可配得图a点所示混合液
的两份溶液等体积混合,可配得图a点所示混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)
B. 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C. 点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)
D. 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com