
(1)两性
形成蛋白质的多肽链的两端存在着自由的_________与_________。而且,侧链中也有_________或_________基团。因此,蛋白质与氨基酸一样也是两性分子,既能与_________反应,又能与_________反应。
(2)水解
蛋白质在酸、碱或酶的作用下,水解成相对分子质量较小的_________化合物,最终逐步水解得到各种_________。
(3)盐溶和盐析
少量的盐(如硫酸铵、硫酸钠、氯化钠等)能___________,这种作用称为盐溶。当向蛋白质溶液中加入的盐溶液达到一定浓度时,反而使蛋白质的溶解度___________,这种作用称为盐析。蛋白质的盐析是一个_________过程,盐析出的蛋白质稀释后仍能溶解,并不影响蛋白质的活性。
(4)变性
在某些_________或_________的影响下,蛋白质的理化性质和生理功能发生改变的现象,称为蛋白质的变性。物理因素包括:_________、加压、搅拌、振荡、_________照射、超声波等;化学因素包括:_________、_________、_________、三氯乙酸、乙醇、丙酮等。
蛋白质的变性是一个__________过程。
(5)颜色反应
含_________的蛋白质遇到浓硝酸会有_________沉淀产生,加热沉淀变_________,这种现象称为颜色反应。
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
 A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.| A | B | D | E | |
| 化合价 | -4 | -2 | -3 | -2 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||








查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
2004年诺贝尔化学奖授予以色列科学家阿龙·切哈诺沃、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了“泛素调节下的蛋白质降解”。人的很多疾病就是这一降解过程不正常导致的。
(1)泛素是由一种76个氨基酸组成的多肽,就像标签一样,无用的蛋白质就被这种“死亡之吻”物质粘贴,被运送到细胞内的“垃圾处理厂”,在细胞E1、E2和E3三种酶激活、辨认和捆绑下,经过蛋白酶体的处理,蛋白质就被切成由7至9个氨基酸组成的短链。根据以上信息,下列说法正确的是( )
A.人体合成的蛋白质在细胞内降解与人食用的蛋白质在胃中降解产物完全相同
B.E1、E2和E3三种酶都属于蛋白质
C.酶具有专一性、高效性等
D.76个氨基酸分子形成的链状泛素分子中最多有76个肽键
(2)蛋白质的降解是一个复杂的过程,一个具有抗菌性质的多肽,短杆菌肽S,它的结构如下图所示:

已知甘氨酸与丙氨酸形成的二肽:H2NCH2CONHCH(CH3)COOH可简单表示为:甘·丙;以上图中汉字均表示某种氨基酸的简称,其中鸟为鸟氨酸,是一种罕见的氨基酸,结构简式为H2N(CH2)3CHNH2COOH。下列说法不正确的是( )
A.短杆菌肽S可看作环十肽
B.短杆菌肽S含有十个肽键
C.鸟氨酸既可与酸反应也可与碱反应
D.短杆菌肽S在某种蛋白酶体作用下生成一系列产物中只有三肽,这些三肽最多有二种
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期末联考化学试卷(解析版) 题型:填空题
(8分)A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表。Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子。
|
|
A |
B |
D |
E |
|
化合价 |
-4 |
-2 |
-3 |
-2 |
|
电负性 |
2.5 |
2.5 |
3.0 |
3.5 |
(1)基态Fe原子的电子排布式为 。
(2)Fe、Co两元素的第三电离能I3(Fe) I3(Co)(填“<”或“>”)。
(3)B、D、E的气态氢化物的沸点由高到低的顺序为 (填化学式)。
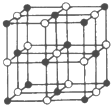
(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为 。(用元素符号表示)

(5)Co的离子能与AD-离子生成各种配合物。紫色的配离子[Co(AD)6]4- 是一种相当强的还原剂,在加热时能与水反应生成[Co(AD)6]3-。
①HAD分子中A元素的杂化类型为 ,D元素的化合价为 。
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省潍坊市高三2月月考化学试卷 题型:填空题
【物质结构与性质】(8分)
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Cu、Fe、Zn等,其中铜及其合金是人类最早使用的金属材料,用途广泛。
(1)铜原子的核外电子排布式是 ;O、N、S的第一电离能由大到小的顺序为 。
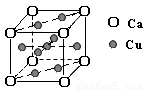
(2)铜的熔点比钙高,其原因是 ;
右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键B.金属键C.极性共价键D.非极性共价键E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)。
A.平面正方形 B.正四面体 C.三角锥型 D.V型
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:
HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com