
| A. | 在相同条件下:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ/mol | |
| B. | 1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ | |
| C. | 在相同条件下,C(石墨,s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol | |
| D. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
分析 A、根据石墨、一氧化碳的燃烧的热化学方程式,利用盖斯定律,进行方程式叠加,构造出目标反应式;
B、1mol石墨不完全燃烧,无法计算生成CO2和CO各自物质的量,无法计算具体反应热;
C、根据石墨、一氧化碳的燃烧的热化学方程式,利用盖斯定律,进行方程式叠加,构造出目标反应式;
D、金刚石的燃烧热大于石墨的燃烧热,可知金刚石的能量比石墨能量高,根据能量守恒判断.
解答 解:A、热化学方程式为(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol;
一氧化碳燃烧的热化学方程式为(2)CO(g)+1/2O2(g)═CO2(g)△H2=-283.0kJ/mol;
根据盖斯定律,(1)-(2)得C(石墨)+1/2O2(g)=CO(g);△H=-110.5kJ•mol-1,
即2C(石墨)+O2(g)=2CO(g);△H=-221kJ•mol-1,故A错误;
B、1mol石墨不完全燃烧生成CO2和CO,无法计算生成CO2和CO各自物质的量,无法计算具体反应热,故B错误;
C、1mol石墨和1mol一氧化碳完全燃烧生成二氧化碳时的放热分别 是△H=-393.5kJ/mol和△H=-283kJ/mol,
则热化学方程式为(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol;
一氧化碳燃烧的热化学方程式为(2)CO(g)+1/2O2(g)═CO2(g)△H2=-283.0kJ/mol;
根据盖斯定律,(1)-(2)×2得C(s,石墨)+CO2(g)=2CO(g);△H=+172.5kJ•mol-11,故C正确;
D、金刚石的燃烧热大于石墨的燃烧热,根据能量守恒,可知金刚石的能量比石墨能量高,所以石墨转变为金刚石需要吸热,故D错误;
故选:C.
点评 主要考查盖斯定律,热化学方程式书写等,难度中等,关键在于根据已知反应构造目标反应式.注意:(3)当反应式乘以或除以某数时,△H也应乘以或除以某数. (2)反应式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“-”符号,即把△H看作一个整体进行运算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D. | 4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
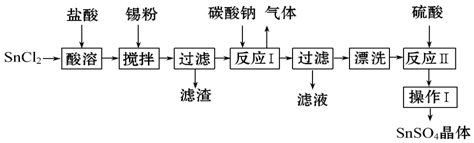
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═2Al3++3SO42- | B. | FeCl2═Fe2++3Cl- | ||
| C. | H2SO4═H2++SO42- | D. | Ca(OH)2═Ca2++2(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中的钢闸门连接电源的负极 | B. | 金属护拦表面涂漆 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 地下钢管连接锌板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 逆反应速率増大,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 逆反应速率减小,正反应速率増大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
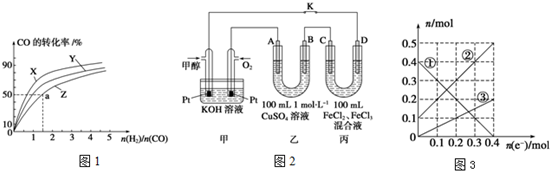
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
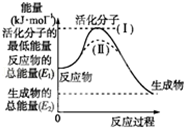 I.请认真观察图,然后回答问题.
I.请认真观察图,然后回答问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com