
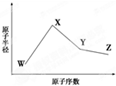
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/ kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
分析 I.W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素;
Ⅱ.(1)SiC与Si均为原子晶体,键能越大,化学键越稳定,熔点越高;
SiCl4 属于分子晶体,而SiO2属于原子晶体,原子晶体熔点高于分子晶体的;
(2)反应热=反应物总键能-生成物总键能,在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键,1mol 硅单质有2mol共价键.
解答 解:I.W、X、Y、Z是四种常见的短周期元素,已知W的一种核素的质量数为18,中子数为10,则W元素原子的质子数为18-10=8,故W为氧元素;X和Ne原子的核外电子数相差1,X为Na或F,X原子半径大于氧原子,故X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na元素,故Y为Si元素;Z的非金属性在同周期元素中最强,故Z为Cl元素.
(1)X为Na,处于周期表中:第三周期第ⅠA族,
原子核外电子数为11,W为氧元素,其基态原子核外电子排布为1s22s22p4,核外有2个未成对电子,
故答案为:第三周期第ⅠA族;2;
(2)X为Na、Y为Si,Na的熔点较低,Si为原子晶体,熔点很高,故Si的熔点高于Na的;由于非金属性Cl>Br,故氢化物稳定性:HCl>HBr,
故答案为:Si;HCl;
(3)Y与Z形成的化合物为SiCl4,SiCl4和足量的水反应,生成一种弱酸和一种强酸,反应方程式为:SiCl4+4H2O=H4SiO4↓+4HCl,
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl;
Ⅱ.(1)碳化硅和硅都是原子晶体,Si-C键能大于Si-Si键能,所以Si-C键更稳定,故熔点SiC>Si,
SiCl4 属于分子晶体,而SiO2属于原子晶体,原子晶体熔点高于分子晶体的,故熔点SiCl4<SiO2
故答案为:>;<;
(2)反应热=反应物的键能之和-生成物的键能之和,在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键,1mol 硅单质有2mol共价键,则△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol,
故答案为:+236.
点评 本题考查位置结构性质关系、晶体类型与熔沸点比较、反应热计算等,反应热计算为易错点,关键是明确共价键数目,难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
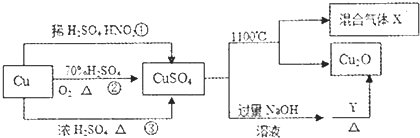
| A. | 途径①、②和③都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是甲醛溶液 | |
| C. | CuSO.在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,因Cu2+水解得不到胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅是非金属元素,它的单质是灰黑色有金属光泽的固体 | |
| D. | 加热到一定温度时硅能与H2、O2等非金属反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子的骨架分类方法一般用于烃的分类 | |
| B. | 五个碳原子的环状化合物肯定是脂环化合物 | |
| C. | 不含苯环的碳环化合物都属于脂环化合物 | |
| D. | 芳香化合物就是指苯及苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
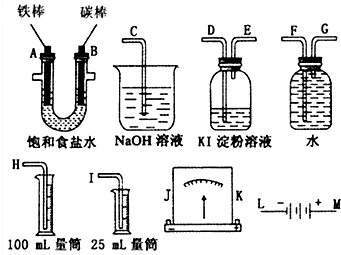 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
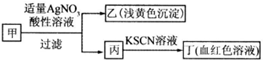
| A. | 如果甲中含有S2-,则乙是S沉淀 | |
| B. | 如果乙是AgBr沉淀,那么甲一定是FeBr3 | |
| C. | 丙中肯定含有Fe3+,所以甲是FeBr2 | |
| D. | 甲中含有铁元素,可能显示+2或者+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解NaCl溶液,可以实现反应:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑ | |
| B. | 用铜、铝作电极与电解质溶液构成原电池时,铜一定是正极 | |
| C. | N2O4和NO2混合气体69g,完全与水反应转移电子数约为6.02×1023 | |
| D. | HCl和HS-均是含有一个极性键的18电子粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com