
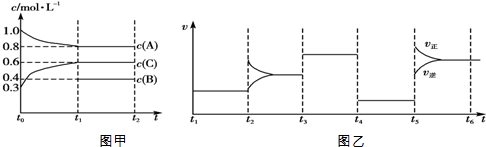
| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
分析 图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件:
t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,而t3~t4阶段为使用催化剂,t4~t5的速率又变慢,则t4~t5阶段为降低压强,因此应该推断该反应前后气体体积不变;
t2~t3阶段改变条件的瞬间,其中某一速率增大、另外速率不变,应是增大某一组分的浓度;
t5~t6阶段改变条件的瞬间,正、逆速率都增大,且正反应速率增大较大,平衡向正反应方向移动,说明正反应为吸热反应;
随反应进行反应物的浓度降低,生成物的浓度增大,结合图甲可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应前后气体体积不变,所以B为反应物,B的浓度变化量为0.3mol/L-0.2mol/L=0.1mol/L,故A、B、C的化学计量数之比为0.2:0.1:0.3=2:1:3,则该反应方程式为:2A(g)+B(g) 3C(g),据此解答.
3C(g),据此解答.
解答 解:图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件:
t3~t4和t4~t5这两段平衡是不移动的,则只能是压强和催化剂影响的,而t3~t4阶段为使用催化剂,t4~t5的速率又变慢,则t4~t5阶段为降低压强,因此应该推断该反应前后气体体积不变;
t2~t3阶段改变条件的瞬间,其中某一速率增大、另外速率不变,应是增大某一组分的浓度;
t5~t6 阶段改变条件的瞬间,正、逆速率都增大,且正反应速率增大较大,平衡向正反应方向移动,说明正反应为吸热反应;
随反应进行反应物的浓度降低,生成物的浓度增大,结合图甲可知,A为反应物,C为生成物,A的变化为0.2mol/L,C的变化量为0.3mol/L.又由于该反应前后气体体积不变,所以B为反应物,B的浓度变化量为0.3mol/L-0.2mol/L=0.1mol/L,故A、B、C的化学计量数之比为0.2:0.1:0.3=2:1:3,则该反应方程式为:2A(g)+B(g) 3C(g),
3C(g),
A.由上述分析可知,该反应为吸热反应,故A正确;
B.由上述分析可知,B的浓度变化量为0.1mol/L,由图可知平衡时B的浓度为0.4mol/L,故B在t0~t1阶段平衡时的转化率为$\frac{01mol/L}{0.1mol/L+0.4mol/L}$×100%=20%,故B错误;
C.由上述分析可知,t4~t5阶段改变的条件为减小压强,故C正确;
D.由图可知,平衡时A、B、C的浓度分别为0.8mol/L、0.4mol/L、0.6mol/L,发生反应为:2A(g)+B(g) 3C(g),故该温度下平衡常数K=$\frac{0.{6}^{3}}{0.{8}^{2}×0.4}$=$\frac{27}{32}$,故D正确,
3C(g),故该温度下平衡常数K=$\frac{0.{6}^{3}}{0.{8}^{2}×0.4}$=$\frac{27}{32}$,故D正确,
故选B.
点评 本题考查化学平衡图象、化学平衡有关计算、化学平衡影响元素、平衡常数计算等,关键是根据平衡移动图象分析反应特征、书写反应方程式,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 | |
| B. | 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 | |
| C. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| D. | 对于同一元素而言,原子的逐级电离能越来越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 剩余固体 | Cu(NO3)2、CuO | Cu2O、CuO | Cu2O、CuO | Cu(NO3)2、Cu2O |
| 剩余气体 | 无气体剩余 | 氧气2.5×10-3mol | NO 2.5×10-3mol | 氧气2.5×10-3mol |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
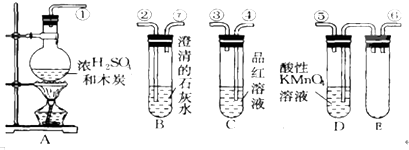
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
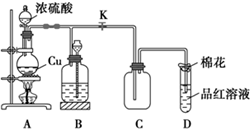 (1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:
我国煤炭资源比石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com