

| 物质 | 熔点/℃ | 沸点/℃ | |
| SiCl4 | -70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
| Si3N4 | 1900 | - | 性质稳定 |
分析 根据题目给出的信息,A中加热碳酸氢铵固体分解制备氨气,B为除去分解产生的二氧化碳和水蒸气的除杂装置,C为氨气与SiCl4蒸气均匀混合装置,D为SiCl4蒸气和NH3在1400℃、无水、无氧条件下反应制取氧化硅装置,E为冷切收集装置,F为尾气处理装置,
(1)A中加热碳酸氢铵固体分解制备氨气,B为除去分解产生的二氧化碳和水蒸气的除杂装置;
(2)热水浴加热的优点为药品受热均匀,容易控制温度;
(3)反应开始前先组装好仪器,检查装置的气密性,再加装药品,加热装置A制备氨气,滴加SiCl4,使其余氨气均匀混合,再加热装置D,让其发生反应制备氮化硅;
(4)装置D中为氨气与SiCl4发生反应生成Si3N4和12HCl;
(5)根据反应3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$ Si3N4+12HCl,生成的氮化硅受冷变为无色液体HCl遇到挥发出来的氨气结合成氯化铵,产生白烟的现象,
(6)氮化硅在碱性条件下加热水解生成硅酸钠和氨气,用盐酸吸收氨气生成氯化铵,过量的盐酸用氢氧化钠溶液滴定,可确定剩余盐酸的量,从而计算与氨气反应的盐酸的物质的量,最终确定氮元素的物质的量,从而计算氮化硅的纯度;
(7)Si3N4与氢氟酸反应,生成四氟化硅和氟化铵.
解答 解:根据题目给出的信息,A中加热碳酸氢铵固体分解制备氨气,B为除去分解产生的二氧化碳和水蒸气的除杂装置,C为氨气与SiCl4蒸气均匀混合装置,D为SiCl4蒸气和NH3在1400℃、无水、无氧条件下反应制取氧化硅装置,E为冷切收集装置,F为尾气处理装置,
(1)A中加热碳酸氢铵固体分解制备氨气,B为除去分解产生的二氧化碳和水蒸气的除杂装置,试剂选用碱石灰,
故答案为:碱石灰;
(2)C中的锥形瓶需要热水浴,热水浴加热的优点为药品受热均匀,容易控制温度,
故答案为:药品受热均匀,容易控制温度;
(3)反应开始前先组装好仪器,检查装置的气密性,再加装药品,加热装置A制备氨气,滴加SiCl4,使其余氨气均匀混合,再加热装置D,让其发生反应制备氮化硅,
故答案为:检查装置的气密性;③②①;
(4)装置D中为氨气与SiCl4发生反应的装置,化学方程式为3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$ Si3N4+12HCl,
故答案为:3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$ Si3N4+12HCl;
(5)根据反应3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$ Si3N4+12HCl,生成的氮化硅受冷变为无色液体HCl遇到挥发出来的氨气结合成氯化铵,产生白烟的现象,
故答案为:有无色液体生成,并产生白烟;
(6)氮化硅在碱性条件下加热水解生成硅酸钠和氨气,用盐酸吸收氨气生成氯化铵,过量的盐酸用氢氧化钠溶液滴定,可确定剩余盐酸的量,从而计算与氨气反应的盐酸的物质的量,最终确定氮元素的物质的量,
①氮化硅在碱性条件下加热水解生成硅酸钠和氨气,离子方程式为Si3N4+6OH-+3H2O=3SiO32-+4NH3↑,
故答案为:Si3N4+6OH-+3H2O=3SiO32-+4NH3↑;
②取吸收后所得溶液20.00mL,过量的盐酸用氢氧化钠溶液滴定时,用掉0.2500mol•L-1NaOH溶液32.00mL,物质的量为0.2500×0.032L=0.008mol,即过量的盐酸的物质的量为0.008mol,则200mL中过量的盐酸的物质的量为0.08mol,盐酸总的物质的量为0.200L×3.000mol•L-1=0.6mol,故与氨气反应的盐酸的物质的量为0.6-0.08=0.52mol,NH3+HCl=NH4Cl,则氨气为0.52mol,根据氮原子守恒知,n( Si3N4)=$\frac{0.52}{4}$=0.13mol,产品中Si3N4的质量分数=$\frac{0.13×140}{200}×100%$=9.10%,
故答案为:9.10%;
(7)Si3N4与氢氟酸反应,生成四氟化硅和氟化铵,
故答案为:NH4F.
点评 本题考查了物质的转化和制备题,还考查了化学方程式的书写.本题利用文字描述设计出相应的实验步骤,分步骤进行鉴别,解决本考点需要根据实验现象,综合分析,从而得出正确的结论,要注意知识的整体性,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液,看是否有沉淀生成 | B. | 将水加热煮沸,看是否有沉淀生成 | ||
| C. | 加入NaOH溶液,看是否有沉淀生成 | D. | 加入少量肥皂水,看是否有沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
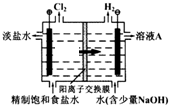 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
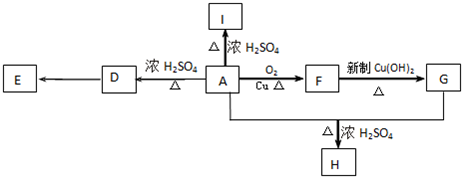
 ;E
;E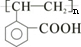 ;
;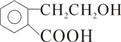 +O2
+O2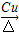 2
2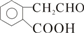 +2H2O;
+2H2O;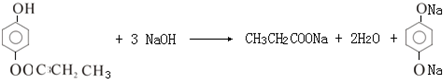 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温、高压、适当的催化剂 | |
| B. | 高温、常压 | |
| C. | 尽可能高温、高压 | |
| D. | 适当的温度、适当的高压,适宜催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

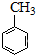 $→_{水溶加热}^{浓H_{2}SO_{4}浓HNO_{3}}$
$→_{水溶加热}^{浓H_{2}SO_{4}浓HNO_{3}}$
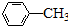 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$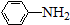 (弱碱性,易被氧化)
(弱碱性,易被氧化) .
.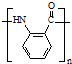 .
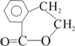
. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构. →B
→B 等.
等. 的同分异构体:
的同分异构体: 、
、 等
等 属于不同类别
属于不同类别 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷燃烧 | |
| B. | 乙烯通入酸性高锰酸钾溶液中 | |
| C. | 在镍做催化剂的条件下,苯与氢气反应 | |
| D. | 乙烷与氯气在光照下反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com