
| ||
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
| ||
| ||
| 3mol |
| 3 |
| 1mol×(3+2x) |
| 4x |
| 3+2x |
| 4x |
| 3+2x |
| 4x |
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
| ||
| ||


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:阅读理解
 Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是
Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
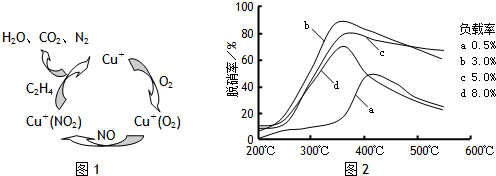
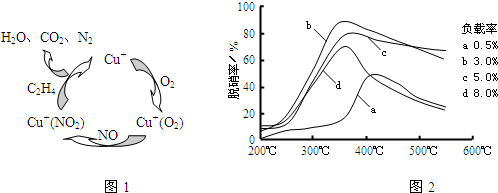
| 方法Ⅰ | 用硫和氮的氧化物之间的相互转化联合进行的脱硫和脱硝技术 |
| 方法Ⅱ | 用乙烯作为还原剂将氮的氧化物还原为N2的脱硝技术 |
| 方法Ⅲ | 用电化学原理将SO2转化为重要的化工原料H2SO4的脱硫技术 |

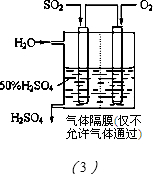
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com