
分析 铜只能和浓硫酸反应和稀硫酸不反应,酸性环境下,铜可以被硝酸根离子氧化生成可溶性铜盐,据此解答.
解答 解:铜只能和浓硫酸反应和稀硫酸不反应,Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则10mol•L-1的浓硫酸的实际体积要大于180mL;若使剩余的铜片继续溶解,可向其中加入硝酸盐,应为溶液中有H+,再加入硝酸盐引入NO3-,相当于存在了硝酸,硝酸能将同溶解,反应实质为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:>;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查了元素化合物的性质,熟悉铜与硫酸反应的条件及硝酸根离子在酸性环境下的强的氧化性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电源的负极就是阴极 | |
| B. | 与直流电源正极相连的是电解池的阴极 | |
| C. | 与直流电源负极相连的电极上发生还原反应 | |
| D. | 阳极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1=Q2 | C. | 2Q1>Q2 | D. | Q2=Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2 g | B. | 4.8 g | C. | 5.4 g | D. | 3.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
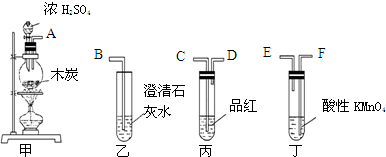
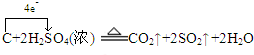 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
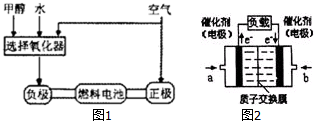
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com