
下列推断正确的是( )
A.CO2和CH4都是引起“温室效应”的气体
B.Na2O、Na2O2的组成元素相同,故与CO2反应的产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.分别向新制氯水和久置氯水中滴加少量紫色石蕊试液,充分振荡后溶液都呈红色
科目:高中化学 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2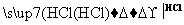 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验 序号 | 初始浓度c/mol·L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.001 0 | 290 |
| ② | 1.60 | 0.20 | 0.001 0 | 145 |
| ③ | 0.80 | 0.40 | 0.001 0 | 145 |
| ④ | 0.80 | 0.20 | 0.002 0 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大[CH3COCH3],v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大[HCl],v(Br2)增大
D.增大[Br2],v(Br2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中正确的是( )
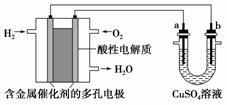
A.燃料电池工作时,正极反应为:O2+2H2O+4e-===4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,a极上产生的O2与电池中消耗的H2体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为________极。
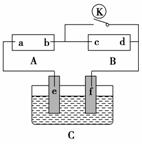
(2)滤纸B上发生的总化学反应方程式为__________________________________________________________
__________________________________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为__________________________,电极f上发生的反应为________________________,槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在查阅资料时发现:化工厂常用氨气来检验氯气是否泄漏。于是他们设计实验探究氯气与氨气之间的反应。
制备气体的实验装置有(可重复选用):
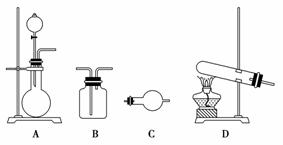
实验药品有:a.MnO2(s) b.浓盐酸 c.浓氨水 d.KClO3(s) e.碱石灰
f.浓硫酸 g.饱和食盐水 h.NaOH(s) i.消石灰
请回答下列问题。
(1)利用上述实验装置与药品制备干燥氨气,应选用的装置有________(填字母序号)。
(2)制取干燥氯气的装置由A、B、B组装而成,则B中应装的试剂依次是________(填字母序号),A中发生反应的化学方程式为__________________________________________________________。
(3)为使氯气、氨气在如图所示装置中充分混合并反应,在a口通入的气体是________,若氨气量较多,则瓶内会出现大量白烟,该白烟为__________________________。
(4)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,若氯气过量,氯气与氨气反应生成两种化合物,其中一种化合物分子的空间构型与NH3相似,则该反应的化学方程式为__________________________________________________________
__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
软锰矿是制备二氧化锰的原料,软锰矿中含有二氧化硅、氧化铜、氧化铁、氧化铝、氧化锌等杂质。工业上以软锰矿为原料制备高纯二氧化锰的工艺流程图如下:
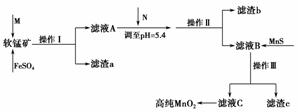
(1)酸性条件下,FeSO4将MnO2还原为MnSO4,那么加入的酸M为________,该反应的离子方程式为______________________________。
(2)制备二氧化锰工艺流程中涉及的阳离子以氢氧化物的形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 10.4 |
由流程图信息和表格中数据可知滤渣b的主要成分是________(填化学式)。调节溶液pH=5.4需加入试剂N,N可以是________。
a.CO2 b.稀硫酸 c.NH3 d.氨水
(3)部分硫化物的溶度积常数(Ksp)如下表:
| 硫化物 | CuS | ZnS | MnS | FeS |
| Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由表格中的数据推知流程图中向滤液B中加入MnS的作用是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,浓度均为0.1 mol·L-1的6种溶液pH如下:
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
请根据上表数据回答:
(1)常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是__________(用A、B、C表示)。
A.H2SiO3 B.H2SO3 C.H2CO3
(2)在上述NaHCO3溶液中加0.1 mol·L-1CaCl2,不能产生CaCO3沉淀的原因:________________________________________________________________________。
(3)6种溶液中,水的电离程度最小的是________(填化学式)。
(4)若增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是________(填化学式)。
(5)等浓度的H2SO3和NaHSO3混合液,加入少量的强酸或强碱溶液,pH值都没有明显变化,请解释之。(用离子方程式表示)_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法错误的是( )
A.医学上常用酒精消毒,是因为酒精能使细菌蛋白变性
B.聚酯纤维、光导纤维都属于有机高分子材料
C.对废旧电池回收处理是为了防止重金属污染水源和土壤
D.绿色化学的核心是从源头上减少和消除化工生产对环境的污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com