
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C(碳)的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知中和热△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3 kJ | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出热量28.7 kJ,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
分析 A、燃烧热是正值,而且是生成稳定的氧化物;
B、1mol的可燃物生成稳定的氧化物,所以是1mol的氢气完全燃烧放出的热量;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量;
D、醋酸电离是吸热的过程,所以放出的热量小于57.4 kJ.
解答 解:A、燃烧热是正值,而且是生成稳定的氧化物,而不是一氧化碳,故A错误;
B、1mol的可燃物生成稳定的氧化物,所以是1mol的氢气完全燃烧放出的热量,所以则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.5×2 kJ•mol-1,故B错误;
C、中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,所以将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3 kJ,故C正确;
D、醋酸电离是吸热的过程,所以放出的热量小于57.4 kJ,故D错误;
故选C.
点评 本题考查了热化学方程式的书写方法和注意问题,主要是燃烧热、中和热概念的分析判断,能量守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原混合气体中H2S的体积可能是75mL | |
| B. | 原混合气体中O2的体积可能是50mL | |
| C. | 剩余25 mL气体可能全部是SO2 | |
| D. | 剩余25 mL气体可能是SO2与O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的生成速率等于它的消耗速率 | B. | v(SO2)正=2v(O2)逆 | ||
| C. | 各组分的反应速率均相等 | D. | 反应体系中混合物的组成保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
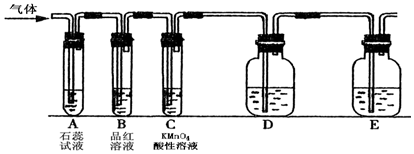
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 不纯物质 | 除杂试剂 | 分离方法 | 必用仪器 |
| A | 碘(水) | 四氯化碳 | 萃取 | 分液漏斗 |
| B | 氯化钾(氯化钙) | 适量盐酸 | 过滤 | 玻璃棒 |
| C | 硝酸铜(硝酸银) | 适量铜粉 | 结晶 | 酒精灯 |
| D | 硫酸钾(碳酸钾) | 适量盐酸 | 蒸馏 | 温度计 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正常雨水pH等于7,酸雨的PH小于7 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
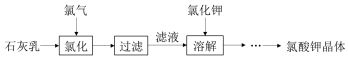
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com