
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
分析 有机物和足量的钠反应,该有机物中可能含有-OH或-COOH或-OH、-COOH,该机物与足量的小苏打溶液反应,说明该有机物含有-COOH.有机物与钠反应、与碳酸氢钠反应,二者生成的气体体积相等,则有机物中羧基数目与羟基数目相等,据此结合选项判断.
解答 解:有机物和足量的钠反应,该有机物中可能含有-OH或-COOH或-OH、-COOH,该机物与足量的小苏打溶液反应,说明该有机物含有-COOH.有机物与钠反应、与碳酸氢钠反应,二者生成的气体体积相等,则有机物中羧基数目与羟基数目相等.
A、HO(CH2)2CHO中不含羧基,不能碳酸氢钠反应,故A不符合;
B、HO(CH2)2COOH中羧基与羟基数目相等,该有机物与钠反应、与碳酸氢钠反应,二者生成的气体体积相等,故B符合;
C、HOOC-COOH中不含羟基,该有机物与钠反应、与碳酸氢钠反应,二者生成的气体体积之比为1:2,故C不符合;
D、(CH3)3CCOOH中不含羟基,该有机物与钠反应、与碳酸氢钠反应,二者生成的气体体积之比为1:2,故D不符合,
故选B.
点评 本题考查醇、羧酸的性质与有机物结构推断等,难度不大,清楚醇、羧酸的性质是解题关键,注意基础知识的掌握


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
铝制饭盒 | 聚乙烯盒 | 铁罐车 | 带玻璃塞的试剂瓶 |
| 不宜长时间存放 酸性或碱性的食物 | 能用于盛放食品 | 可用于运输浓硫酸 | 可用于盛放 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
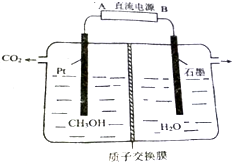 工业废水中的甲醇也可用电化学方法处理,原理如图所示.
工业废水中的甲醇也可用电化学方法处理,原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 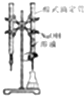 如图装置可用于已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. |  如图装置可用于氯化铵固体和氢氧化钙固体反应制取少量氨气 | |
| C. | 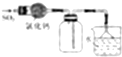 如图装置可用于收集SO2,并吸收多余的SO2 | |
| D. | 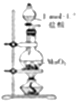 如图装置可用于制取少量Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 | |
| B. | 过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率 | |
| C. | 电解质溶液导电的过程中,一定发生了电解质溶液的电解 | |
| D. | 溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
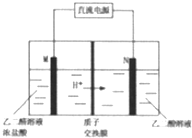 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | N电极上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CH0+H2O | |
| B. | 若有2molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1mol | |
| C. | M电极上的电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:Y>Z>X | |
| C. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 | |
| D. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
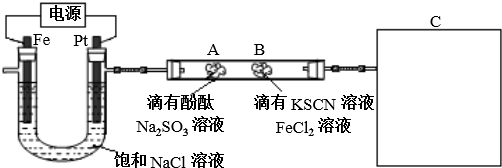
 他猜想:SCN-可能被氯水氧化,导致溶液变黄.
他猜想:SCN-可能被氯水氧化,导致溶液变黄.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com