
【题目】下列水溶液一定呈中性的是
A.c(NH4+)=c(C1-)的NH4Cl 溶液
B.c(H+)=1×10-7mol·L-1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH= 11的碱等体积混合后的溶液
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①MgSO4,②Ba(NO3)2,③NaOH,④CuCl2,⑤KCl五种溶液,不加任何其他试剂,可鉴别且鉴别的先后顺序也正确的是
A.④③②①⑤ B.④⑤③②① C.④③①②⑤ D.④②③①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现实验目的,选用的装置、实验操作均正确的是( )
实验目的 | 实验步骤和装置 | |
A | 探究温度对反应速率的影响 | 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间 |
B | 配制100mL1.0mol/L NaOH溶液 | 向100mL容量瓶中加入4. 0gNaOH固体,加水到刻度线 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 比较H2O2 和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
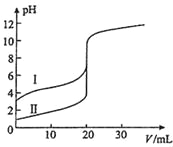
A. Ⅱ表示的是滴定醋酸的曲线
B. PH=7时,滴定醋酸消耗V(NaOH)小于20mL
C. V(NaOH)=20mL时,c(Cl﹣)=c(CH3COO﹣)
D. V(NaOH)=10mL时,醋酸溶液中:c(Na+)>c(CH3COO﹣ )>c(H+)>c(OH﹣ )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O中,被还原的氯原子和被氧化的氯原子的个数之比为
A.1:6 B.5:1 C.1:5 D.6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人类可以主动参与氮循环,合成氨工业就是参与的手段之一。以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多优点。其过程大体如图1所示:

①请写出用天然气制备氢气的化学方程式:_________________________________;
②写出合成尿素[CO (NH2) 2]反应的化学方程式:__________________________;
③写出O2与NH3在有催化剂的条件下反应生成NH4NO3和H2O的化学方程式:______;
④每生产1molNH4NO3最少需要NH3______mol,而要生产这些NH3又最少需要CH4____mol;
(2)科学家已获得极具理论研究意义的N4分子,其结构为正四面体(如图2).已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为N2时要释放______kJ能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com