
| A. | 肺炎 | B. | 胃酸过多 | C. | 脑膜炎 | D. | 外伤感染 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| M | 最高价氧化物对应的水化物能按1:1电离出电子数相等的阴、阳离子 |
| Q | 所在主族序数与所在周期序数之差为4,非金属性在同周期元素中最强 |
| X | 其单质为淡黄色晶体 |
| Y | 某种核素原子的质量数为56,中子数为30 |
| Z | X元素的单质在Z元素的单质中燃烧,发出明亮的蓝紫色火焰 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加压若平衡正向移动,则a>c | |
| B. | 加入一定量的B,平衡一定正向移动 | |
| C. | 缩小容器的体积,各物质的浓度一定增大 | |
| D. | 升高温度,平衡一定正向移动,混合气体的平均摩尔质量的变化不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
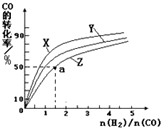 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com