
【题目】利用太阳能、风能、生物质能等可再生能源,转化利用二氧化碳设计出适合高效清洁的合成燃料分子结构,实现CO2+H2O→CxHy的分子转化,生产合成甲烷、醇醚燃料、烷烃柴油、航空燃油等可再生合成燃料。因此二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol
CH4(g)+H2O(g) △H1=-206.2kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2
CO2(g)+H2(g) H2
若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则△H2=__。
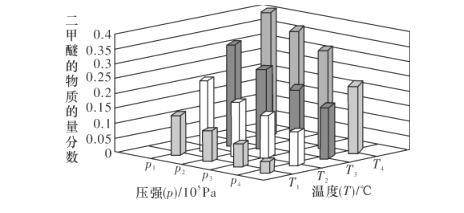
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
(3)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①该反应△H__(填“>”“<”或“=”)0。
②下列叙述能说明此反应达到平衡状态的是__(填字母代号)。
a.混合气体的平均相对分子质量保持不变
b.1molCO2生成的同时有3molH-H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)% | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
CH3OH的产 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为__催化效果最佳。
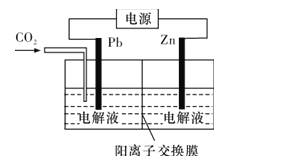
(4)CO2可用于工业制备草酸锌,其原理如图所示(电解液不参加反应),Zn电极是__极。已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为__。
【答案】-41.2kJ/mol > < 57.1% < ab 60 阳 2CO2+2e-==C2O42-
【解析】
(1)由“若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ”,我们可写出热化学方程式为:CO2(g)+4H2(g)==CH4(g)+2H2O(g) △H=-165.0kJ/mol,利用盖斯定律,可求出△H2。
(2)正反应为放热的体积缩小的可逆反应,依据平衡移动原理,增大压强、降低温度,平衡都正向移动,提取图中信息,便可得出p1与p2、K3与K4关系及T1、p1时H2的平衡转化率。
(3)①利用H-TS<0,可判断该反应的△H与0的关系。
②a.混合气体的平均相对分子质量保持不变,则气体的总物质的量不变;
b.1molCO2生成的同时有3molH-H键断裂,反应的方向相反,数值之比等于化学计量数之比;
c.对于该反应,CO2的转化率和H2的转化率始终相等;
d.对于该反应,混合气体的密度始终保持不变。
③由表中数据,可确定CuO的催化效果的最佳点。
(4)因为在Pb电极区得到ZnC2O4,则表明Pb电极上CO2得电子,作阴极,由此可确定Zn电极作电解池的电极名称,并可写出Pb电极上的电极反应式。
(1)由“若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ”,我们可写出热化学方程式为:
CO2(g)+4H2(g)==CH4(g)+2H2O(g) △H=-165.0kJ/mol ①
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol ②
CH4(g)+H2O(g) △H1=-206.2kJ/mol ②
利用盖斯定律,将②-①,即得CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=-41.2kJ/mol。答案为:-41.2kJ/mol;
CO2(g)+H2(g) H2=-41.2kJ/mol。答案为:-41.2kJ/mol;
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1,
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1,
正反应为放热的体积缩小的可逆反应,依据平衡移动原理,增大压强,平衡正向移动;降低温度,平衡正向移动,平衡常数增大。提取图中信息,p1、T4时,二甲醚的物质的量分数大,所以p1>p2,T3>T4,则K3<K4。从图中可以看出,T1、p1时,二甲醚的物质的量分数为0.1,假设某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,CO2的变化量为2x,三段式为:

则![]() ,x=
,x=![]() mol,H2的平衡转化率为
mol,H2的平衡转化率为![]() =57.1%。答案为:>;<;57.1%;
=57.1%。答案为:>;<;57.1%;
(3) ①S<0,利用H-TS<0,可判断该反应的△H<0。答案为:<;
②a.混合气体的平均相对分子质量保持不变,则气体的总物质的量不变,表明反应达平衡状态,a符合题意;
b.1molCO2生成的同时有3molH-H键断裂,反应的方向相反,数值之比等于化学计量数之比,表明反应达平衡状态,b符合题意;
c.对于该反应,反应物的起始投入量之比等于化学计量数之比,所以不管反应进行到什么程度,CO2的转化率和H2的转化率始终相等,则反应不一定达平衡状态,c不合题意;
d.对于该反应,混合气体的质量与体积都不变,所以密度始终保持不变,反应不一定达平衡状态,d不合题意。答案为:ab;
③由表可知,CuO的质量分数为60%时,CH3OH的产率、CO2的转化率都达最大值,催化效果最佳。答案为:60; (4)因为在Pb电极区得到ZnC2O4,则表明Pb电极上CO2得电子,Zn电极失电子作阳极;在阴极,CO2得电子生成C2O42-,与从阳极区通过阳离子交换膜迁移的Zn2+在阴极区发生反应生成ZnC2O4,电极反应式为2CO2+2e-==C2O42-。答案为:阳;2CO2+2e-==C2O42-。


科目:高中化学 来源: 题型:
【题目】经过德国化学家哈伯、波施等的不懈努力,成功地开发了合成氨的生产工艺。如今 世界各国科学家为提高氨的产量,降低能耗做着各种有益的探索。试回答下列问题:
(1)已知NH3(l)NH3(g) △H1;N2(g)+3H2(g)2NH3(l) △H2 。则反应N2(g)+3H2(g)2NH3(g) 的△H=_______(用含 △H1、△H2的代数式表示)
(2)①在一定条件下,分别将 1mol N2和3mol H2置于恒压容器Ⅰ和恒容容器Ⅱ中 两容器起始容积相同充分反应,二者均达到平衡状态,则两容器中NH3 的体积分数是Ⅰ_______Ⅱ(填“>”、“<”或“=” 。)
②上述容积恒定的密闭容器中,达化学平衡状态时, 若NH3 的体积分数为10% ,若保持其他条 件不变,起始时改为充入2 mol N2和2molH2,达新平衡后,NH3的体积分数为_______10%填(“>”、“<”或“=”)。
(3)哈伯因证实 N2、H2 在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用![]() 分别表示 N2、H2、NH3 和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示:
分别表示 N2、H2、NH3 和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示:
![]()
①吸附后,能量状态最低的是___________填字母序号)。
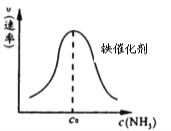
②由上述原理,在铁表面进行 NH3 的分解实验,发现分解速率与浓度关系如图。从吸附和解吸过程分析,c0前速率增加的原因可能是_________________________;c0 后速率降低的原因可能是___________________。
(4)已知液氨中存在:2NH3(l)NH2-+NH4+。用 Pt 电极对液氨进行电解也可产生 H2和 N2。阴极的电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到目的的是( )
选项 | 目的 | 实验 |
A | 制取较高浓度的次氯酸溶液 | 将Cl2通入小苏打溶液中 |
B | 除去溴苯中的少量溴 | 加入苛性钠溶液洗涤、分液 |
C | 加快氢气的生成速率 | 将与稀硫酸反应的粗锌改为纯锌 |
D | 制备少量氨气 | 向新制生石灰中滴加浓氨水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
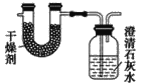
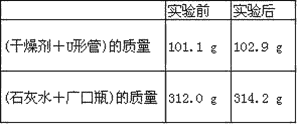
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为_____________g。
(2)生成的水中氢元素的质量为_______g。
(3)生成的二氧化碳中碳元素的质量为_______ g。
(4)该燃料中碳元素与氢元素的质量比为_______。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为_______,结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物中可用分液漏斗分离,且有机物应从分液漏斗上口倒出的是 ( )
A.![]() 、Br2
、Br2
B.CH3Cl、H2O
C.CCl4、CHCl3
D.CH2Br—CH2Br、NaBr(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃A在一定条件下可以按框图进行反应:

已知:①D是
②F1和F2互为同分异构体
③G1和G2互为同分异构体
根据框图信息,填写下列空白:
(1)A的结构简式是____。
(2)框图中属于取代反应的是(填数字代号):____。
(3)框图中①、③、⑥属于____反应。
(4)G1的结构简式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值,下列说法不正确的是
A.2 mol SO2 和 1 mol O2 混合在 V2O5 存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
B.某温度下纯水的 pH=6,该温度下 1L pH=11 的NaOH 溶液中含OH-的数目为 0.1NA
C.一定温度下,1 L 0.5 mol·L -1 NH4Cl 溶液与 2 L 0.25 mol·L -1NH4Cl 溶液含NH+均为 0.5NA
D.100 g CaCO3 与 KHCO3 的混合物中含有的阴离子的数目为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )

A.Ⅰ曲线代表HClO,Ⅱ曲线代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO32-
C.图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com