
 为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:| 溴化铁 |
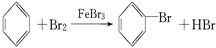 ;Br-+Ag+═AgBr↓;
;Br-+Ag+═AgBr↓;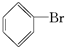 与Br2;NaOH溶液(或水);分液漏斗;
与Br2;NaOH溶液(或水);分液漏斗; ;可以控制反应进行;避免杂质干扰;防止污染空气.
;可以控制反应进行;避免杂质干扰;防止污染空气.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:

 (R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
(R、R'代表烃基或氢原子).合成P的路线如图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
查看答案和解析>>
科目:高中化学 来源: 题型:
 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴石蕊试剂 | 溶液变成红色 |
| ②取少量原溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ③取②中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于稀HNO3 |
| ④取少量原溶液,加NaOH溶液至过量 | 有白色沉淀生成,当NaOH过量时有部分沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH(OH)CH3 |
| B、CH2(OH)CH(OH)CH3 |
| C、CH3CH2CH2OH |
| D、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com