
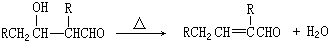
 ;
; +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$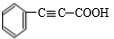 +2NaBr+2H2O
+2NaBr+2H2O +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$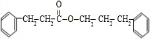 +H2O.
+H2O.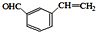 、
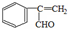
、 、
、
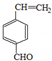 .
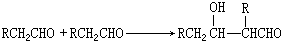
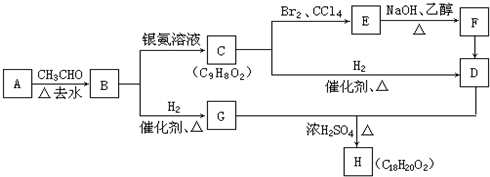
. 分析 C分子式为C9H8O2,B发生银镜反应生成C,故B中含有醛基,C中含有-COOH,B的分子式为C9H8O,B的不饱和度为$\frac{2×9+2-8}{2}$=6,B属于芳香族化合物,苯环饱和度为4,-CHO不饱和度为1,故还含有1个C=C双键,A与乙醛加成生成B,由醛加成反应的信息可知,A为 ,故B为
,故B为 ,C为
,C为 ,C与溴发生加成反应生成E,E为
,C与溴发生加成反应生成E,E为 ,E在氢氧化钠醇溶液、加热条件下发生消去反应生成F,则F为
,E在氢氧化钠醇溶液、加热条件下发生消去反应生成F,则F为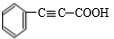 ,C与氢气加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为$\frac{2×18+2-20}{2}$=9,故还含有2个苯环,故D为
,C与氢气加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为$\frac{2×18+2-20}{2}$=9,故还含有2个苯环,故D为 ,G为
,G为 ,H为
,H为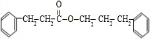 ,据此解答.
,据此解答.
解答 解:C分子式为C9H8O2,B发生银镜反应生成C,故B中含有醛基,C中含有-COOH,B的分子式为C9H8O,B的不饱和度为$\frac{2×9+2-8}{2}$=6,B属于芳香族化合物,苯环饱和度为4,-CHO不饱和度为1,故还含有1个C=C双键,A与乙醛加成生成B,由醛加成反应的信息可知,A为 ,故B为
,故B为 ,C为
,C为 ,C与溴发生加成反应生成E,E为
,C与溴发生加成反应生成E,E为 ,E在氢氧化钠醇溶液、加热条件下发生消去反应生成F,则F为
,E在氢氧化钠醇溶液、加热条件下发生消去反应生成F,则F为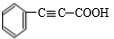 ,C与氢气加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为$\frac{2×18+2-20}{2}$=9,故还含有2个苯环,故D为
,C与氢气加成生成D,D中含有-COOH,D与G反应生成H,H为酯,G含有-OH,H分子式为C18H20O2,不饱和度为$\frac{2×18+2-20}{2}$=9,故还含有2个苯环,故D为 ,G为
,G为 ,H为
,H为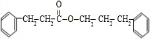 ,
,
(1)根据上面的分析可知,B为 ,B所含官能团的名称为碳碳双键和醛基,
,B所含官能团的名称为碳碳双键和醛基,
故答案为:碳碳双键和醛基; ;
;
(2)A为 ,A的核磁共振氢谱有4个峰,
,A的核磁共振氢谱有4个峰,
故答案为:4;
(3)E→F的化学方程式为 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$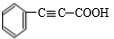 +2NaBr+2H2O,
+2NaBr+2H2O,
故答案为: +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$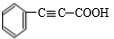 +2NaBr+2H2O;
+2NaBr+2H2O;
(4)G与D反应生成H的化学方程式为: +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$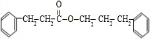 +H2O,
+H2O,
故答案为: +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$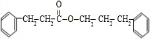 +H2O;
+H2O;
(5)F为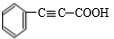 ,F若与H2发生加反应,苯环和碳碳参键都能与氢气加成,所以1mol F最多消耗的H2的物质的量为 5mol,
,F若与H2发生加反应,苯环和碳碳参键都能与氢气加成,所以1mol F最多消耗的H2的物质的量为 5mol,
故答案为:5;
(6)B为 ,芳香族化合物M与B互为同分异构体,且含有相同的官能团,则M结构简式为
,芳香族化合物M与B互为同分异构体,且含有相同的官能团,则M结构简式为 、
、 、
、 、
、 ,
,
故答案为: 、
、 、
、 、
、 ;
;
点评 本题考查有机物推断,涉及烯烃、醇、羧酸、醛等性质,需要对给予的信息进行利用,是对有机化合物知识的综合考查,能较好的考查考生的自学能力和推理能力,难度中等,是高考热点题型.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:填空题
 .
.
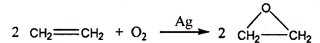

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
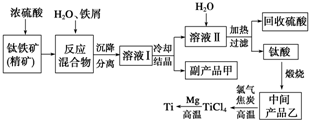 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 实验③中反应的离子方程式为Fe+Fe3+═2Fe2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量的FeCl2溶液 | B. | 加入适量的KBr溶液 | ||
| C. | 加入适量的饱和食盐水 | D. | 加入适量的Na2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量的6mol•L-1的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入数滴硝酸铜溶液 | D. | 加入适量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②⑤ | B. | ①④②⑤ | C. | ①③②⑥ | D. | ①⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com