
| A. | 溶液的pH值 | B. | 电离度 | ||
| C. | 电离平衡常数 | D. | 平衡后,氨水的电离速率 |
分析 A.氨水溶液的pH与氨水浓度、溶液温度、一水合氨电离程度等因素有关;
B.电解质的电离程度与溶液浓度及溶液温度有关;
C.电离平衡常数只与温度有关;
D.平衡后,一水合氨电离速率与温度有关、与溶液浓度有关.
解答 解:A.氨水溶液的pH与氨水浓度、溶液温度、一水合氨电离程度等因素有关,温度越高弱电解质的电离程度越大、溶液浓度越大而一水合氨电离程度越小,所以影响因素不只温度,故A错误;
B.电解质的电离程度与溶液浓度及溶液温度有关,所以影响因素不只温度,故B错误;
C.电离平衡常数只与温度有关,与其它任何因素都无关,故C正确;
D.平衡后,一水合氨电离速率与温度有关、与溶液浓度有关,所以影响因素不只温度,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离影响因素是解本题关键,注意:化学平衡常数、电离平衡常数、盐类水解平衡常数、溶度积常数等都只与温度有关,与溶液酸碱性及溶解性强弱都无关.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡的是
2Z(g)一定达到化学平衡的是
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加NaOH | B. | 加HCl | C. | 加NH4Cl | D. | 加同浓度的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视液面 | B. | 容量瓶洗净后有少量水残留 | ||
| C. | 转移时没有洗涤烧杯和玻璃 | D. | 所用的氢氧化钠已吸水潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3溶液中加入甲酸无明显现象产生 | |
| B. | 25℃时,向甲酸中加入NaOH溶液,HCOOH的电离程度和K均增大 | |
| C. | 向碳酸中加入NaHCO3固体,c(H+)减小 | |
| D. | 向0.1 mol•L-1甲酸中加入蒸馏水,c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
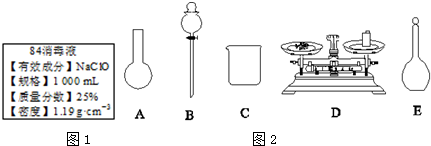
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com