
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
 H++B2-
H++B2-查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| | 冷轧含锌 废水水质 | 经处理后的水国 家环保标准值 |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知25°C时:
| 电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积 | 1.8×10-11 | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | 9.7 | 5.0 | 5.5 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示,请回答: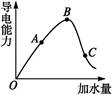
(1)“O”点导电能力为0的理由是 。
(2)A、B、C三点溶液c(H+)由小到大的顺序为 。
(3)若使C点溶液中c(CH3COO-)增大的同时溶液的c(H+)减小,可采取的措施是:
① ;② ;③ 。
(4)经实验测得C点处:c(CH3COOH)="0.1" mol·L-1,c(CH3COO-)="0.01" mol·L-1,则该条件下CH3COOH的电离常数Ka= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(创新预测题)已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与
时间t的关系如图所示。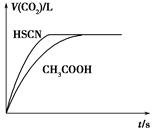
反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)______c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。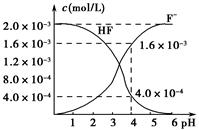
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.利用含锰废水(主要含Mn2+、SO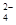 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下: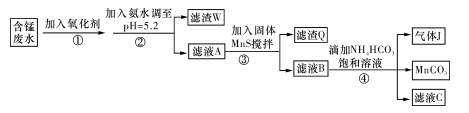
已知某些物质完全沉淀的pH如下表: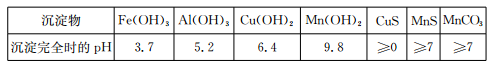
回答下列问题:
(1)过程②中,所得滤渣的主要成分是 。
(2)过程③中,发生反应的离子方程式是 。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是 。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。
现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 (用百分数表示,小数点后保留1位)。
Ⅱ.常温下,浓度均为0.1 mol/L的下列六种溶液的pH如下表: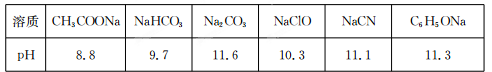
(1)上述盐溶液中的阴离子,结合H+能力最强的是 。
(2)根据表中数据判断,浓度均为0.0l mol/L的下列物质的溶液中,酸性最强的是
(填序号)。
A.HCN B.HC1O C.C6H5OH D.CH3 COOH E.H2 CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填序号)。
A.HCN+ Na2 CO3=NaHCO3+NaCN
B.CH3 COOH+NaCN=CH3 COONa+HCN
C.CO2 +H2O+2C6 H5ONa=Na2 CO3 +2C6 H5OH
D.CH3 COONa+HClO=NaClO十CH3 COOH
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知H2A是一种无机二元酸,请回答以下问题:
(1) 若H2A为二元弱酸,在水溶液中的电离方程式为 ;
(2) 若NaHA溶液显碱性,则H2A是 (填“强酸”、“弱酸”或“无法确定”),原因是 。
(3) 若溶液显酸性,在25℃下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 ;
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=0.1 mol·L-1
c.c(Na+)>c(K+) d.c(Na+)=c(HA-)+c(A2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com