
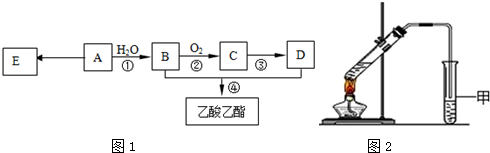
 .
.分析 有机物A的产量可以用来衡量一个国家的石油化工发展水平,则A是CH2=CH2,CH2=CH2和H2O反应生成CH3CH2OH,则B是CH3CH2OH,CH3CH2OH被O2氧化生成C,C反应生成D,D和乙醇反应生成乙酸乙酯,则D是CH3COOH,C是CH3CHO,A反应生成E,E是高分子化合物,则E结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:有机物A的产量可以用来衡量一个国家的石油化工发展水平,则A是CH2=CH2,CH2=CH2和H2O反应生成CH3CH2OH,则B是CH3CH2OH,CH3CH2OH被O2氧化生成C,C反应生成D,D和乙醇反应生成乙酸乙酯,则D是CH3COOH,C是CH3CHO,A反应生成E,E是高分子化合物,则E结构简式为 ,
,
(1)A是CH2=CH2,D是CH3COOH,A中官能团名称是碳碳双键、D中官能团名称是羧基,反应①的反应类型是加成,故答案为:碳碳双键;羧基;加成.
(2)该反应为乙醇的催化氧化反应,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应④为乙酸和乙醇的酯化反应,该反应的化学方程式是CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(3)E是聚乙烯,乙烯发生加聚反应生成聚乙烯,反应方程式为:nCH2=CH2$\stackrel{一定条件下}{→}$ ,故答案为:nCH2=CH2$\stackrel{一定条件下}{→}$
,故答案为:nCH2=CH2$\stackrel{一定条件下}{→}$ ;
;
(4)①实验开始时,试管甲中的导管不伸入液面下是为了防止倒吸,故答案为:防倒吸;
②饱和碳酸钠溶液能溶解乙醇,能和乙酸反应生成二氧化碳和可溶性的乙酸钠,能降低乙酸乙酯溶解度,从而更好的析出乙酸乙酯,故选BC;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,不能生成1mol乙酸乙酯,因为该反应是可逆反应,当反应达到一定限度时达到平衡状态,故答案为:不能;该反应为可逆反应,有一定的限度,不可能完全转化.
点评 本题考查有机物推断和乙酸乙酯的制取,为高频考点,明确官能团及其性质关系、乙酸乙酯制取方法及原理是解本题关键,注意乙酸乙酯制取中饱和碳酸钠溶液的作用,不能将饱和碳酸钠溶液换为NaOH溶液,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的实质是电子转移 | B. | 氧化剂在反应中本身被还原 | ||
| C. | 氧化反应和还原反应同时进行 | D. | 氧化还原反应一定有单质参加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| B. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
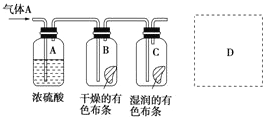
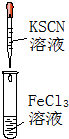 | 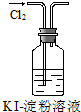 |  |  |
| ① | ② | ③ | ④ |
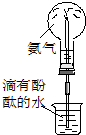
| A. | 实验①试管中混合溶液中出现红色沉淀 | |
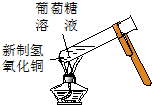
| B. | 实验②中溶液变黄色 | |
| C. | 实验③中烧瓶内溶液变红色 | |
| D. | 实验④中出现黑色氧化铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: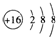 | B. | 中子数为10的氧原子:${\;}_{18}^{8}$O | ||
| C. | HClO的电子式: | D. | 硝基苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
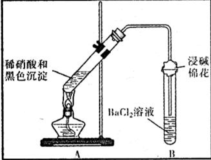 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能说明H2CO3是弱电解质:HCO3-+H2O?H2CO3+OH- | |
| B. | 能说明溶解性AgCl强于AgI:AgCl+I-═Cl-+AgI | |
| C. | 能说明盐酸是强酸:HCl+AgNO3═AgCl↓+HNO3 | |
| D. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;A→F
;A→F
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com