
铝热反应操作:
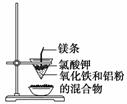
现象:“纸漏斗”内混合物立即剧烈反应,发出________________,产生大量的烟。“纸漏斗”被烧破,有红热状态的液珠落入蒸发皿内的细沙上。液珠冷却后变为________________色固体。
化学方程式:__________________________________________________________。
应用:铝热反应能______________,常用于焊接钢轨和大截面的钢材部件。
问题:(1)镁条和氯酸钾的作用是__________________________。
(2)引发铝热反应的操作是__________________________________。
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
将4 g NaOH固体溶于水配成250 mL溶液,此溶液中NaOH的物质的量浓度为__________。取出10 mL此溶液,这10 mL溶液中NaOH的物质的量浓度为___________,其中含有NaOH________g。将取出的溶液加水稀释到100 mL,稀释后的溶液中NaOH的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。
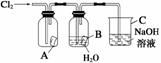
(1)通Cl2一段时间后,A中观察到的现象是__________________________,B中观察到的现象是________________________________,由此可得出的结论是_______,写出有关反应的化学方程式:_____________________________________________________________。
(2)C装置的作用是____________________________________,理由是______,写出有关反应的化学方程式:_________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,试管中集满干燥的氯气,胶头滴管中装有供反应的足量浓氨水。滴入浓氨水,开始时试管内发生的有氧化还原反应:NH3+Cl2→N2+H Cl并产生红光和白烟。
Cl并产生红光和白烟。
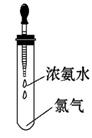
请根据以上反应和现象回答下列问题:
(1)标志反应全部完成的现象是 _______________________________________。
_______________________________________。
(2)反应完毕后,将试管浸入水中并倒立着试管,取下滴管,有水进入试管。在室温时,进入试管内的水约占试管容积的________。
(3)反应中生成的白烟是________。
(4)写出试管中反应的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的Al分别加入到0.3 L 1 mol·L-1的盐酸和NaOH溶液中,生成氢气的体积比为1∶2,则加入Al的质量为( )
A.2.7 g B.5.4 g
C.8.1 g D.10 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.稀硫酸不具有氧化性 B.NH4Cl中只含有离子键
C.可用丁达尔效应区分溶液和胶体 D.金属阳离子被还原时一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是
A.钠保存在煤油中 B.用带玻璃塞的试剂瓶盛放NaOH溶液
C.用棕色试剂瓶盛放新制的氯 D.向盛放氯化亚铁溶液的试剂瓶中加少量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
 ② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:





 Fe3+ + SO32- + == F e2+ + +
Fe3+ + SO32- + == F e2+ + +
乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| III | 向1 mol•L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是______(填字母)。
a.K3 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定某溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法错误的是
A.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H2O
B.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com