
| A. | 64gCaC2晶体中阴离子数目是2NA | |
| B. | 36g冰晶体中氢键数目是4NA | |
| C. | pH=13的NaOH溶液中阴阳离子总数目为0.2NA | |
| D. | 1L0.1mol•L-1FeCl3溶液中Fe3+水解产生的H+数目为0.3NA |
分析 A、求出CaC2的物质的量,然后根据1molCaC2中含1mol阴离子C22-来分析;
B、求出冰的物质的量,然后根据1mol冰中含2mol氢键来分析;
C、溶液体积不明确;
D、铁离子是弱碱阳离子,在溶液中会水解,但水解程度不大.
解答 解:A、64gCaC2的物质的量为1mol,而1molCaC2中含1mol阴离子C22-,即含NA个阴离子,故A错误;
B、36g冰的物质的量为2mol,而1mol冰中含2mol氢键,故2mol冰中含4mol氢键即4NA个,故B正确;
C、溶液体积不明确,故溶液中的离子的个数无法计算,故C错误;
D、铁离子是弱碱阳离子,在溶液中会水解,但水解程度不大,即铁离子不能完全水解,则水解产生的氢离子的个数小于0.3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,SiO2和Si都是制造半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明H2SiO3的酸性强于H2CO3 | |
| D. | Na2SiO3溶液中加入盐酸可制备硅酸胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 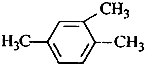 1,3,4-三甲苯 1,3,4-三甲苯 | |
| B. | 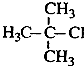 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | |
| C. | 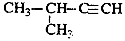 2-甲基-3-丁炔 2-甲基-3-丁炔 | |
| D. | CH3CH2C(CH3)2CH(C2H5)CH3 3,3,4-三甲基已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
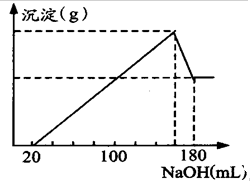 将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液到过量,
将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液到过量,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的H2SO4为0.2mol | B. | 参加反应的NaOH约为0.27mol | ||
| C. | 加入铝粉的质量为5.4g | D. | 与硫酸反应的铝粉的质量7.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com