
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:不详 题型:填空题
 素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的
素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的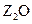 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。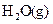 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。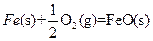
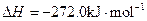

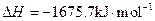
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
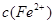 的变化如图所示。下列离子方程式错误的是( )
的变化如图所示。下列离子方程式错误的是( )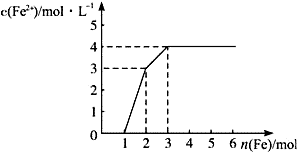
| A.0~1 : Fe+ NO3—+4H+=Fe3++ NO↑+2H2O | B.1~2 : Fe+2Fe3+ =3Fe2+ |
| C.2~3 : Fe+Cu2+=Fe2++Cu | D.0~3 : 3Fe+2Fe3++2Cu2+ =5Fe2++2Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.24 mol | B.0.21 mol | C.0.16 mol | D.0.14 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶
05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶 液的体积变化如下图所示:
液的体积变化如下图所示:
 ,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
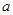 g硫酸铜溶液
g硫酸铜溶液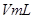 ,将溶液蒸发掉
,将溶液蒸发掉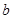 g水后恢复到20°C,恰好全部生成硫酸铜晶体
g水后恢复到20°C,恰好全部生成硫酸铜晶体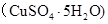 ,则下列关系式错误的是
,则下列关系式错误的是A.原硫酸铜溶液的密度为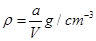 |
B.原硫酸铜溶液的物质的量浓度为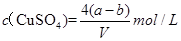 |
C.原硫酸铜溶液的溶质质量分数为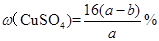 |
D.生成硫酸铜晶体的物质的量为 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁在氯气中燃烧 | B.加热硫粉和铁粉的混合物 |
| C.铁在氧气中燃烧 | D.水蒸气通过灼热的铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com