
已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“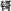 ”;②合理利用核能符合“低碳经济”的要求,
”;②合理利用核能符合“低碳经济”的要求,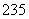 92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
A.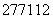 Cn的原子核内中子数与核外电子数之差为55
Cn的原子核内中子数与核外电子数之差为55
B.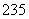 92U和
92U和 92U是同位素,核反应属于化学变化
92U是同位素,核反应属于化学变化
C.40Ca2+与18O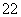 具有相同的电子数
具有相同的电子数
D.Si2O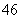 中质子总数为80
中质子总数为80
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
判断下列几组化合物的熔、沸点由高到低的顺序,并简要说明判断理由。
(1)CCl4、CF4、CBr4、CI4:_______________________________________________
________________________________________________________________________
__________________________________。
(2)乙醇、溴乙烷、乙烷:________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图表示某固态
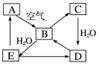
单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式:
________________________________________________________________________。
(2)写出E与A的氢化物反应生成A的化学方程式:
________________________________________________________________________。
(3)写出一个由D生成B的化学方程式:
________________________________________________________________________。
(4)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式:_______________________________________________;
②反应后溶液的pH________7(填“大于”、“小于”或“等于”),理由是________________________________________________________________________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO2,为了便于监控,实施环境保护,下列适合测定硫酸尾气中SO2含量的试剂是( )
A.品红溶液 B.碘水、淀粉溶液
C.氨水、酚酞试液 D.以上都能
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2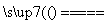 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:___________________。
②实验过程中,需要通入氧气。试写出一个用如下图所示装置制取氧气的化学方程式:________________________________________________________________________。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是_____________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。

①能说明二氧化硫具有氧化性的实验现象为_________________________________
________________________________________________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同。当它作为原子的次外层时,其电子数比(n-1)层多10个,则此电子层是( )
A.K层 B.L层 C.M层 D.N层
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)核外电子排布相同的微粒化学性质也相同( )
(2014·山东理综,8B)
(2)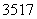 Cl与
Cl与 Cl得电子能力相同( )
Cl得电子能力相同( )
(2014·山东理综,8D)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、L、I九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E、B与G、D与L分别位于同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)__________________________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)____________。
(2)L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为__________________________________________。
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:__________________________________________________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为________________________,向Y中加足量稀硫酸后,再加高锰酸钾溶液,高锰酸钾溶液褪色。写出使高锰酸钾溶液褪色的反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是制备Cu—Zn—Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3(浓)===
Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2===2Cu(NO3)2+2H2O
下列说法正确的是( )
A.制取相同量的硝酸铜需硝酸的量②最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com