
ΓΨΧβΡΩΓΩΜ·ΚœΈοG «“Μ÷÷÷ΈΝΤ≈ΝΫπ…≠÷ΔΒΡ“©ΤΖΘ§ΤδΚœ≥…¬ΖœΏΝς≥ΧΆΦ»γœ¬ΘΚ
Θ®1Θ©D÷–ΒΡΙΌΡήΆ≈Οϊ≥ΤΈΣδε‘≠Ή”ΓΔ______ΚΆ______ΓΘ
Θ®2Θ©BΓΔCΓΔD»ΐ÷÷”–ΜζΈο”κNaOH““¥Φ»ή“ΚΙ≤»»Θ§ΡήΖΔ…ζœϊ»ΞΖ¥”ΠΒΡ «____Θ®ΧνΉ÷ΡΗΘ©ΓΘ
Θ®3Θ©–¥≥ωΆ§ ±¬ζΉψœ¬Ν–ΧθΦΰΒΡDΒΡ“Μ÷÷Ά§Ζ÷“λΙΙΧεΒΡΫαΙΙΦρ ΫΘΚ______ΓΘ
ΔΌΖ÷Ή”÷–÷Μ”–3÷÷≤ΜΆ§Μ·―ßΜΖΨ≥ΒΡ«βΘΜ
ΔΎΡήΖΔ…ζ“χΨΒΖ¥”ΠΘ§±ΫΜΖ…œΒΡ“Μ»Γ¥ζΈο÷Μ”–“Μ÷÷ΓΘ
Θ®4Θ©FΆ®Ιΐ»Γ¥ζΖ¥”ΠΒΟΒΫGΘ§GΒΡΖ÷Ή” ΫΈΣC16H24N2OΘ§–¥≥ωGΒΡΫαΙΙΦρ ΫΘΚ______ΓΘ
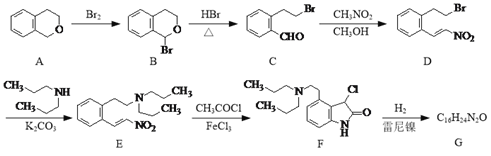
Θ®5Θ©“―÷ΣΘΚ![]() (R¥ζ±μΧΰΜυΜρH)ΓΘ
(R¥ζ±μΧΰΜυΜρH)ΓΘ
«κ–¥≥ω“‘![]() ΚΆCH3NO2ΈΣ‘≠Νœ÷Τ±Η
ΚΆCH3NO2ΈΣ‘≠Νœ÷Τ±Η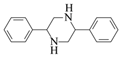 ΒΡΚœ≥…¬ΖœΏΝς≥ΧΆΦ(ΈόΜζ ‘ΦΝΚΆ”–Μζ»ήΦΝ»Έ”ΟΘ§Κœ≥…¬ΖœΏΝς≥ΧΆΦ ΨάΐΦϊ±ΨΧβΧβΗ…)ΓΘ__________________
ΒΡΚœ≥…¬ΖœΏΝς≥ΧΆΦ(ΈόΜζ ‘ΦΝΚΆ”–Μζ»ήΦΝ»Έ”ΟΘ§Κœ≥…¬ΖœΏΝς≥ΧΆΦ ΨάΐΦϊ±ΨΧβΧβΗ…)ΓΘ__________________
ΓΨ¥πΑΗΓΩ ΧΦΧΦΥΪΦϋ œθΜυ CD  Μρ
Μρ
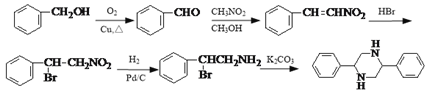
ΓΨΫβΈωΓΩ(1)D(![]() )÷–ΒΡΙΌΡήΆ≈”–δε‘≠Ή”ΓΔΧΦΧΦΥΪΦϋΓΔœθΜυΘ§Ι ¥πΑΗΈΣΘΚΧΦΧΦΥΪΦϋΘΜœθΜυΘΜ
)÷–ΒΡΙΌΡήΆ≈”–δε‘≠Ή”ΓΔΧΦΧΦΥΪΦϋΓΔœθΜυΘ§Ι ¥πΑΗΈΣΘΚΧΦΧΦΥΪΦϋΘΜœθΜυΘΜ
(2)B(![]() )ΓΔC(
)ΓΔC(![]() )ΓΔD(
)ΓΔD(![]() )»ΐ÷÷”–ΜζΈο÷–ΕΦΚ§”–δε‘≠Ή”Θ§ΒΪCD÷–”κδε‘≠Ή”÷±Ϋ”œύΝ§ΒΡΧΦ‘≠Ή”ΒΡΝΎΈΜΧΦ‘≠Ή”…œΚ§”–«β‘≠Ή”Θ§‘ΎNaOH““¥Φ»ή“ΚΙ≤»» ±ΡήΖΔ…ζœϊ»ΞΖ¥”ΠΘ§Ι ¥πΑΗΈΣΘΚCDΘΜ
)»ΐ÷÷”–ΜζΈο÷–ΕΦΚ§”–δε‘≠Ή”Θ§ΒΪCD÷–”κδε‘≠Ή”÷±Ϋ”œύΝ§ΒΡΧΦ‘≠Ή”ΒΡΝΎΈΜΧΦ‘≠Ή”…œΚ§”–«β‘≠Ή”Θ§‘ΎNaOH““¥Φ»ή“ΚΙ≤»» ±ΡήΖΔ…ζœϊ»ΞΖ¥”ΠΘ§Ι ¥πΑΗΈΣΘΚCDΘΜ
(3)DΈΣ![]() Θ§ΔΌΖ÷Ή”÷–÷Μ”–3÷÷≤ΜΆ§Μ·―ßΜΖΨ≥ΒΡ«βΘΜΔΎΡήΖΔ…ζ“χΨΒΖ¥”ΠΘ§ΥΒΟςΫαΙΙ÷–Κ§”–»©ΜυΘ§±ΫΜΖ…œΒΡ“Μ»Γ¥ζΈο÷Μ”–“Μ÷÷Θ§ΥΒΟςΫαΙΙΨΏ”–ΫœΗΏΒΡΕ‘≥Τ–‘Θ§¬ζΉψΧθΦΰΒΡ”–ΘΚ
Θ§ΔΌΖ÷Ή”÷–÷Μ”–3÷÷≤ΜΆ§Μ·―ßΜΖΨ≥ΒΡ«βΘΜΔΎΡήΖΔ…ζ“χΨΒΖ¥”ΠΘ§ΥΒΟςΫαΙΙ÷–Κ§”–»©ΜυΘ§±ΫΜΖ…œΒΡ“Μ»Γ¥ζΈο÷Μ”–“Μ÷÷Θ§ΥΒΟςΫαΙΙΨΏ”–ΫœΗΏΒΡΕ‘≥Τ–‘Θ§¬ζΉψΧθΦΰΒΡ”–ΘΚ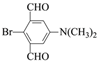 Μρ
Μρ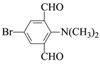 Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ Μρ
Μρ ΘΜ
ΘΜ
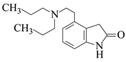
(4)F(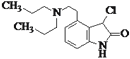 )Ά®Ιΐ»Γ¥ζΖ¥”ΠΒΟΒΫGΘ§GΒΡΖ÷Ή” ΫΈΣC16H24N2OΘ§‘ρGΈΣ
)Ά®Ιΐ»Γ¥ζΖ¥”ΠΒΟΒΫGΘ§GΒΡΖ÷Ή” ΫΈΣC16H24N2OΘ§‘ρGΈΣ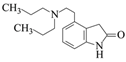 Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ ΘΜ
ΘΜ
(5)“‘![]() ΚΆCH3NO2ΈΣ‘≠Νœ÷Τ±Η
ΚΆCH3NO2ΈΣ‘≠Νœ÷Τ±Η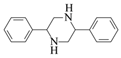 Θ§ΗυΨίΧβΗ…Νς≥ΧΆΦ÷–D…ζ≥…EΒΡΧα ΨΘ§Κœ≥…
Θ§ΗυΨίΧβΗ…Νς≥ΧΆΦ÷–D…ζ≥…EΒΡΧα ΨΘ§Κœ≥… –η“Σœ»Κœ≥…
–η“Σœ»Κœ≥…![]() Θ§ΗυΨίΧβΗ…Νς≥ΧΆΦ÷–C…ζ≥…DΒΡΧα ΨΘ§Κœ≥…
Θ§ΗυΨίΧβΗ…Νς≥ΧΆΦ÷–C…ζ≥…DΒΡΧα ΨΘ§Κœ≥…![]() Ω…“‘œ‘Κœ≥…
Ω…“‘œ‘Κœ≥…![]() Θ§‘ΌΚœ≥…
Θ§‘ΌΚœ≥…![]() Θ§
Θ§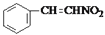 Ω…“‘”…
Ω…“‘”…![]() ―θΜ·≥…
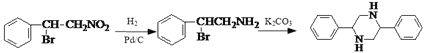
―θΜ·≥…![]() Κσ”κCH3NO2Φ”≥…Φ¥Ω…Θ§“ρ¥ΥΚœ≥…¬ΖœΏΈΣ
Κσ”κCH3NO2Φ”≥…Φ¥Ω…Θ§“ρ¥ΥΚœ≥…¬ΖœΏΈΣ![]()
 Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ![]()
 ΓΘ
ΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΚ§ΝΉΜ·ΚœΈο‘Ύ…ζ≤ζ…ζΜν÷–”–Ή≈÷Ί“ΣΒΡ”Π”ΟΓΘ
Θ®1Θ©ΝΉ”κΑ± «Ά§÷ςΉε‘ΣΥΊΘ§œ¬Ν–ΡήΥΒΟς’ΏΖ«Ϋπ τ–‘«Ω»θΒΡ «_______(ΧνΉ÷ΡΗ)ΓΘ
a.NH3±»PH3Έ»Ε®–‘«Ω
b.≥ΘΈ¬œ¬Θ§ΒΣΤχΈΣΤχΧεΘ§ΝΉΒΞ÷ ΈΣΙΧΧε
c.ΒΣΤχ”κ«βΤχΜ·Κœ±»ΝΉ”κ«βΤχΜ·ΚœΗϋάßΡ―
d.HNO3ΒΡΥα–‘±»HPO3Υα–‘«Ω
Θ®2Θ©ΙΛ“Β≥Θ”ΟΝΉΨΪΩσ[Ca5(PO4)3F]ΚΆΝρΥαΖ¥”Π÷ΤΗςΝΉΥαΓΘΦΚ÷Σ25ΓφΘ§101kPa ±:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΓςH=-271kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) ΓςH=-937kJ/mol
‘ρCa5(PO4)FΚΆΝρΥαΖ¥”Π÷Τ±ΗΝΉΥαΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣ________________ΓΘ
Θ®3Θ©“―÷ΣPCl5(g)![]() PCl3(g)+Cl2(g)ΓςH>0ΓΘΈ¬Ε»ΈΣT ±Θ§Α―“ΜΕ®ΝΩΒΡPCl5ΤχΧε“ΐ»κ“Μ’φΩ’ΤΩΡΎΘ§Ζ¥”Π¥οΤΫΚβΚσPCl5”κPCl3ΒΡΖ÷―Ι÷°±»ΈΣ1:3(Ζ÷―Ι“ΜΉή―ΙΓΝΈο÷ ΒΡΝΩΖ÷ ΐ)ΓΘ
PCl3(g)+Cl2(g)ΓςH>0ΓΘΈ¬Ε»ΈΣT ±Θ§Α―“ΜΕ®ΝΩΒΡPCl5ΤχΧε“ΐ»κ“Μ’φΩ’ΤΩΡΎΘ§Ζ¥”Π¥οΤΫΚβΚσPCl5”κPCl3ΒΡΖ÷―Ι÷°±»ΈΣ1:3(Ζ÷―Ι“ΜΉή―ΙΓΝΈο÷ ΒΡΝΩΖ÷ ΐ)ΓΘ
ΔΌPCl5ΒΡΖ÷Ϋβ¬ a1=_____%ΓΘ»τ¥οΒΫ–ΥΚβΚσΧεœΒΉή―ΙΈΣ1.4MPaΘ§”ΟΤΫΚβΖ÷―Ι¥ζΧφΤΫΚβ≈®Ε»±μ ΨΖ¥”ΠΒΡΤΫΚβ≥Θ ΐKp=_________ΓΘ
ΔΎΈ¬Ε»ΈΣT2 ±Θ§–¬ΒΡΤΫΚβΧεœΒ÷–PCl5”κCl2Ζ÷―ΙœύΆ§Θ§‘ρPCl5ΒΡΖ÷Ϋβ¬ a1________a2Θ§Έ¬Ε»T1___T2(ΧνΓΑ>Γ±ΓΑ<Γ±ΜρΓΑ=Γ±)ΓΘ
Δέ¥οΒΫΤΫΚβΚσΘ§œ¬Ν–«ιΩω ΙPCl5Ζ÷Ϋβ¬ ‘ω¥σΒΡ «___________(ΧνΉ÷ΡΗ)ΓΘ
a.Έ¬Ε»ΓΔΧεΜΐ≤Μ±δΘ§≥δ»κκ≤Τχ b.ΧεΜΐ≤Μ±δΘ§Ε‘ΧεœΒΦ”»»
C.Έ¬Ε»ΓΔΧεΜΐ≤Μ±δΘ§≥δ»κ¬»Τχ d.Έ¬Ε»≤Μ±δΘ§‘ω¥σ»ίΤςΧεΜΐ
Θ®4Θ©―θΜ·Υ°ΫβΖ®≤ζ»ΐ¬»―θΝΉΒΡΖœΥ°÷–÷ς“ΣΚ§”–H3PO4ΓΔH3PO3Β»Θ§Ω…œ»Φ”»κ ΝΩΤ·ΑΉΖέΘ§‘ΌΦ”»κ…ζ ·Μ“ΒςΫΎpHΫΪΝΉ‘ΣΥΊΉΣΜ·ΈΣΝΉΥαΒΡΗΤ―Έ≥ΝΒμ≤ΔΜΊ ’ΓΘ
ΔΌ‘Ύ≥ΝΒμ«Αœ»Φ”»κ ΝΩΤ·ΑΉΖέΒΡΉς”Ο «__________________ΓΘ
ΔΎœ¬ΆΦ «≤ΜΆ§ΧθΦΰΕ‘ΝΉΒΡ≥ΝΒμΜΊ ’¬ ΒΡ”ΑœλΆΦœώΓΘ¥ΠάμΗΟ≥ßΖœΥ°–ηΩΊ÷ΤΒΡΙΛ“’ΧθΦΰΈΣ______ΓΘ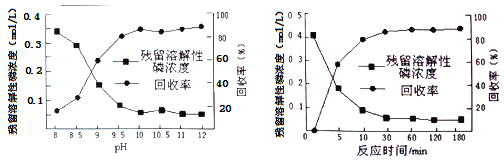
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Μ·―ß–ΓΉιΈΣ≤βΕ®“ΜΕ®÷ ΝΩΒΡΡ≥Ά≠¬ΝΜλΚœΈο÷–Ά≠ΒΡ÷ ΝΩΖ÷ ΐΘ§…ηΦΤΝΥ»γœ¬ Β―ιΖΫΑΗΘΚ
ΖΫΑΗΔώΘΚΆ≠¬ΝΜλΚœΈο![]() ≤βΕ®…ζ≥…ΤχΧεΒΡΧεΜΐ
≤βΕ®…ζ≥…ΤχΧεΒΡΧεΜΐ
ΖΫΑΗΔρΘΚΆ≠¬ΝΜλΚœΈο![]() ≤βΕ® Θ”ύΙΧΧεΒΡ÷ ΝΩ
≤βΕ® Θ”ύΙΧΧεΒΡ÷ ΝΩ
œ¬Ν–”–ΙΊ≈–Εœ÷–≤Μ’ΐ»ΖΒΡ «
A. »ή“ΚAΚΆBΨυΩ…“‘ «―ΈΥαΜρ«β―θΜ·ΡΤ»ή“Κ
B. »ή“ΚAΚΆBΨυΩ…“‘―Γ”ΟœΓœθΥα
C. »τ»ή“ΚB―ÔϬ»Μ·Χζ»ή“ΚΘ§‘ρ Β―ιΡ―“‘ Βœ÷
D. Β―ιΖΫΑΗΔρΗϋ±ψ”Ύ Β ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®÷–Θ§≤Μ’ΐ»ΖΒΡ «( )ΓΘ
A.Μ·―ßΖ¥”ΠΈ¥±ΊΑιΥφΡήΝΩ±δΜ·
B.Μ·―ßΖ¥”Π÷–ΒΡΡήΝΩ±δΜ·÷ς“Σ «”…Μ·―ßΦϋ±δΜ·“ΐΤπΒΡ
C.Μ·―ßΖ¥”Π÷–ΡήΝΩ±δΜ·ΒΡ¥σ–Γ”κΖ¥”ΠΈοΒΡΈο÷ ΒΡΝΩΕύ…Ό”–ΙΊ
D.”––¬Έο÷ …ζ≥… «Μ·―ßΖ¥”ΠΒΡΗυ±ΨΧΊ’ς
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩNaFΓΔNaIΓΔMgOΨυΈΣάκΉ”Μ·ΚœΈοΘ§œ÷”–œ¬Ν– ΐΨίΘ§ ‘≈–Εœ’β»ΐ÷÷Μ·ΚœΈοΒΡ»έΒψΗΏΒΆΥ≥–ρ
Έο÷ | ΔΌNaF | ΔΎNaI | ΔέMgO |
άκΉ”ΒγΚ… ΐ | 1 | 1 | 2 |
Φϋ≥ΛΘ®10Θ≠10mΘ© | 2.31 | 3.18 | 2.10 |
A.ΔΌΘΨΔΎΘΨΔέB.ΔέΘΨΔΌΘΨΔΎC.ΔέΘΨΔΎΘΨΔΌD.ΔΎΘΨΔΌΘΨΔέ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΔώ.œ¬ΆΦ «―–ΨΩΦΉΆι”ꬻΤχΖ¥”ΠΒΡ Β―ιΉΑ÷ΟΆΦΓΘ
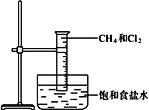
Θ®1Θ©ΦΉΆι”ꬻΤχΖ¥”ΠΒΡΧθΦΰ «___________ΓΘ
Θ®2Θ©Ε଻ֹΆι_____________Ά§Ζ÷“λΙΙΧεΘ®ΧνΓΑ”–Γ±ΜρΓΑΟΜ”–Γ±Θ©ΓΘ
Θ®3Θ©«κΆξ≥…“Μ¬»ΦΉΆι”ꬻΤχΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚCH3Cl+Cl2![]() ________+HClΘ§ΗΟΖ¥”Π τ”ΎΖ¥”Π_________Θ®Χν”–ΜζΖ¥”Πάύ–ΆΘ©ΓΘ
________+HClΘ§ΗΟΖ¥”Π τ”ΎΖ¥”Π_________Θ®Χν”–ΜζΖ¥”Πάύ–ΆΘ©ΓΘ
Δρ.Θ®4Θ©–¥≥ωœ¬Ν–”–ΜζΈοΒΡΫαΙΙΦρ ΫΘΚ
ΔΌ2©¹ΦΉΜυΕΓΆιΘΚ_____________
ΔΎ1©¹ΕΓœ©ΘΚ____________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ“ΜΕ®ΧεΜΐΒΡΟή±’»ίΤς÷–Θ§Ϋχ––»γœ¬Ζ¥”ΠΘΚCO2(g)+H2(g) ![]() CO(g)+H2O(g)Θ§ΤδΜ·―ßΤΫΚβ≥Θ ΐKΚΆΈ¬Ε»tΒΡΙΊœΒ»γœ¬±μΥυ ΨΘΚ
CO(g)+H2O(g)Θ§ΤδΜ·―ßΤΫΚβ≥Θ ΐKΚΆΈ¬Ε»tΒΡΙΊœΒ»γœ¬±μΥυ ΨΘΚ
tΓφ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΗΟΖ¥”ΠΜ·―ßΤΫΚβ≥Θ ΐΒΡ±μ¥ο ΫΘΚK=_______________________________ΘΜ
Θ®2Θ©ΗΟΖ¥”ΠΈΣ________(ΧνΓΑΈϋ»»Γ±ΜρΓΑΖ≈»»Γ±)Ζ¥”ΠΘΜ
Θ®3Θ©œ¬Ν–ΥΒΖ®÷–ΡήΥΒΟςΗΟΖ¥”Π¥οΤΫΚβΉ¥Χ§ΒΡ «__________
AΓΔ»ίΤς÷–―Ι«Ω≤Μ±δ
BΓΔΜλΚœΤχΧε÷–c(CO)≤Μ±δ
CΓΔΜλΚœΤχΧεΒΡΟήΕ»≤Μ±δ
DΓΔc(CO) = c(CO2)
EΓΔΒΞΈΜ ±ΦδΡΎ…ζ≥…COΒΡΖ÷Ή” ΐ”κ…ζ≥…H2OΒΡΖ÷Ή” ΐœύΒ»
Θ®4Θ©Ρ≥Έ¬Ε»œ¬Θ§ΗςΈο÷ ΒΡΤΫΚβ≈®Ε»ΖϊΚœœ¬ ΫΘΚc(CO2)ΓΝc(H2)=c(CO)ΓΝc(H2O)Θ§ ‘≈–¥Υ ±ΒΡΈ¬Ε»ΈΣ__________ΓφΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΘ®1Θ©ΧζΧΩΜλΚœΈο‘ΎΥ°»ή“Κ÷–Ω…–Έ≥…–μΕύΈΔΒγ≥ΊΓΘΫΪΚ§”–Cr2O72-ΒΡΥα–‘ΖœΥ°Ά®ΙΐΧζΧΩΜλΚœΈοΘ§‘ΎΈΔΒγ≥Ί’ΐΦΪ…œCr2O72-ΉΣΜ·ΈΣCr3ΘΪΘ§ΤδΒγΦΪΖ¥”Π ΫΈΣ______________________________________ΓΘ
Θ®2Θ©«βΡή «ΖΔ’Ι÷–ΒΡ–¬Ρή‘¥Θ§ΥϋΒΡάϊ”ΟΑϋά®«βΒΡ÷Τ±ΗΓΔ¥Δ¥φΚΆ”Π”Ο»ΐΗωΜΖΫΎΓΘ”κΤϊ”Άœύ±»Θ§«βΤχΉςΈΣ»ΦΝœΒΡ”≈Βψ «_____________(÷Ν…Ό¥π≥ωΝΫΒψ)ΓΘΒΪ ««βΤχ÷±Ϋ”»Φ…’ΒΡΡήΝΩΉΣΜΜ¬ ‘ΕΒΆ”Ύ»ΦΝœΒγ≥ΊΘ§–¥≥ωΦν–‘«β―θ»ΦΝœΒγ≥ΊΒΡΗΚΦΪΖ¥”Π ΫΘΚ__________________________________ΓΘ
Θ®3Θ©FeSO4‘Ύ“ΜΕ®ΧθΦΰœ¬Ω…÷ΤΒΟFeS2(ΕΰΝρΜ·―«Χζ)Ρ…ΟΉ≤ΡΝœΓΘΗΟ≤ΡΝœΩ…”Ο”Ύ÷Τ‘λΗΏ»ίΝΩο°Βγ≥ΊΘ§Βγ≥ΊΖ≈Βγ ±ΒΡΉήΖ¥”ΠΈΣ4LiΘΪFeS2===FeΘΪ2Li2SΘ§’ΐΦΪΖ¥”Π Ϋ «_____________________________ΓΘ
Θ®4Θ©”“ΆΦΥυ Ψ‘≠Βγ≥Ί’ΐΦΪΒΡΖ¥”Π ΫΈΣ___________________________ΓΘ
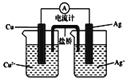
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩC1O2ΉςΈΣ“Μ÷÷«Ω―θΜ·ΦΝΘ§ «ΙζΦ …œΙΪ»œΒΡΗΏ–ßœϊΕΨΟπΨζΦΝΘ§ΒΪ“ρΤδ“Ή±§”–ΕΨΘ§≥Θ”ΟNaClO2Χφ¥ζΓΘ≥ΘΈ¬œ¬Θ§ΫΪNaOHΙΧΧεΦ”»κΒΫ”…0.1molC1O2»ή”ΎΥ°≈δ≥…ΒΡ1L»ή“Κ÷–ΓΘ»ή“ΚpHΦΑ≤ΩΖ÷ΉιΖ÷Κ§ΝΩ±δΜ·«ζœΏ»γΆΦΘ§œ¬Ν––π ω≤Μ’ΐ»ΖΒΡ «

(“―÷ΣΘΚ2C1O2+H2O![]() HC1O2+H++C1O3-)
HC1O2+H++C1O3-)
A. Ka(HClO2)Γ÷10-4.5
B. ≤ΜΡή”ΟpH ‘÷Ϋ≤βΗΟ»ή“ΚΒΡpH
C. Υα–‘ΘΚHClO2<HClO3Θ§―θΜ·–‘ΘΚHClO2>HClO3
D. ΗΟΆΦœώ…œ»ΈΚΈ“ΜΒψΘ§ΕΦ”–cΘ®C1O2-Θ©+cΘ®HC1O2Θ©+cΘ®C1O3-Θ©=0.1molΓΛL-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com