
| A. | 原子由原子核和核外电子构成 | |
| B. | 对于任何微粒,质子数等于核外电子数都成立 | |
| C. | 当微粒达到稳定结构时,最外层电子数一定是8 | |
| D. | 原子的质量等于原子核的质量 |
分析 A、根据原子的结构分析;
B、对于原子,质子数等于核外电子数,对于离子,质子数不等于核外电子数;
C、当最外层为K层,电子数是2即达到稳定结构;
D、原子的质量主要集中在原子核上.
解答 解:A、根据原子的结构,原子由原子核和核外电子构成,故A正确;
B、对于原子,质子数等于核外电子数,对于阳离子,质子数=核外电子数+所带电荷数,对于阴离子,质子数=核外电子数-所带电荷数,故B错误;
C、当最外层为K层,电子数是2即达到稳定结构,故C错误;
D、原子的质量主要集中在原子核上,但不等于原子核的质量,故D错误;
故选A.
点评 本题主要考查了原子的结构以及稳定结构的问题,比较简单,注意基础知识的记忆.


科目:高中化学 来源: 题型:选择题
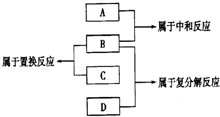 现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )
现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )| A. | A铁 | B. | B盐酸 | C. | C氢氧化钠溶液 | D. | D硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
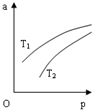 在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )
在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )| A. | T1>T2 | |
| B. | 其他条件不变,增大压强,可提高单位时间内 NH3的产量 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当 n(N2):n(H2):n(NH3)=1:3:2 时,反应一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:H2S>H2Se | B. | 熔点:NaCl>CCl4 | ||
| C. | 酸性:HClO4>H2SO4 | D. | 碱性:NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com