
反应A+3B=2C+2D在四种不同情况下的反应速率可分别为
①v
| A.=0.15 mol/(L·s) ②v | B.=0.6 mol/(L·s) ③v | C.=0.4 mol/(L·s) ④v | D.=0.45 mol/(L·s) |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
已知可逆反应:A(g)+B(g)  C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)=a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol/L,达到平衡后c(D)= 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应,在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00 mol·L-1,c(N2)=3.00 mol·L-1,c(NH3)=4.00 mol·L-1,此温度下该反应的平衡常数K=________。
(2)在三个相同容器中各充入1 mol N2和3 mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是________(填字母)。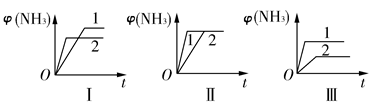
| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1 |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题: (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)??
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示: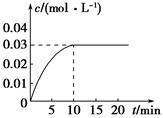
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。
(2)判断该反应达到平衡的依据是________(填序号)。
①CO减小的化学反应速率和CO2减小的化学反应速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
④正、逆反应速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)N2(g)+3H2(g)  2NH3(g) ΔH=-94.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图所示。
2NH3(g) ΔH=-94.4 kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图所示。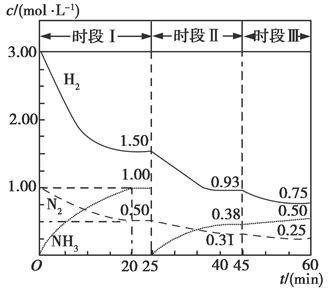
①在1 L容器中发生反应,前20 min内,v(NH3)=________,放出的热量为________。
②25 min时采取的措施是_______________________;
③时段Ⅲ条件下反应的平衡常数表达式为________(用具体数据表示)。
(2)电厂烟气脱离氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO (g)
5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO (g)  5N2O(g)+3H2O(g) ΔH>0。测得平衡混合气中N2和N2O含量与温度的关系如图。在400~600 K时,平衡混合气中N2含量随温度的变化规律是________,导致这种变化规律的原因是________(任答合理的一条原因)。
5N2O(g)+3H2O(g) ΔH>0。测得平衡混合气中N2和N2O含量与温度的关系如图。在400~600 K时,平衡混合气中N2含量随温度的变化规律是________,导致这种变化规律的原因是________(任答合理的一条原因)。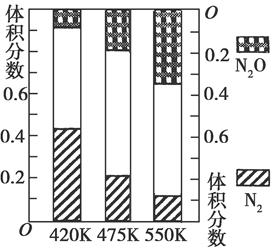
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为4NH3+3O2=2N2+6H2O,则负极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)??2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a的值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%,计算平衡时NH3的物质的量为_____。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数化,下同)n始∶n平=________。
(4)原气体中a∶b=________。
(5)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: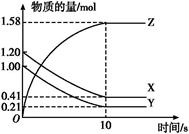
(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示: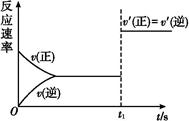
则下列说法符合该图像的是 。
| A.t1时刻,增大了X的浓度 | B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 | D.t1时刻,使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题: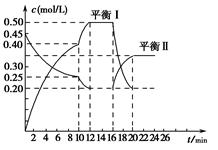
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com