


分析 粗铜中杂质只有Fe,与氯气反应得到固体甲中有氯化铜、氯化铁,用盐酸溶解,抑制氯化铜、氯化铁水解,溶液甲中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液乙为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却到26~42℃结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
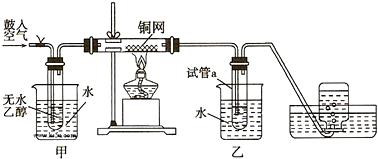
(1)①A装置制备氯气,C装置吸收氯气中的HCl,E装置干燥氯气,D装置中Cu与氯气反应,B装置吸收未反应的氯气,防止污染空气;
②应先制备氯气,排出装置中空气,防止铜被氧气氧化;
(2)①氯化铜、氯化铁在溶液中会发生水解;
②调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质;
③结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却到26~42℃得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体;
(3)氯化铜与N2H4反应得到CuCl,氧化产物为无毒气体,即为氮气,由元素守恒可知,反应还生成HCl;
由于CuCl在热水中迅速水解生成氧化铜水合物,应微热维持反应发生,防止CuCl水解生成氧化铜水合物;
(4)根据Cu元素守恒计算CuCl2•2H2O理论质量,进而计算其产率;在调节溶液pH时,加入CuO或氢氧化铜,会导致CuCl2•2H2O质量增大.
解答 解:粗铜中杂质只有Fe,与氯气反应得到固体甲中有氯化铜、氯化铁,用盐酸溶解,抑制氯化铜、氯化铁水解,溶液甲中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液乙为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却到26~42℃得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)①A装置制备氯气,C装置吸收氯气中的HCl,E装置干燥氯气,D装置中Cu与氯气反应,B装置吸收未反应的氯气,防止污染空气,按气流方向连接各仪器接口顺序是:a→d、e→h、i→f、g→b,
故答案为:d、e、f、g、b;
②应先制备氯气,排出装置中空气,防止铜被氧气氧化,故加热的顺序为先A后D,
故答案为:A;D;排出空气,防止铜被氧气氧化;
(2)①氯化铜、氯化铁在溶液中会发生水解,用盐酸溶解,可以抑制氯化铜、氯化铁水解,
故答案为:抑制氯化铜、氯化铁水解;
②调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质,而氢氧化钠、氨水、硫酸铜均引入杂质,
故选:c;
③结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却到26~42℃结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体,
故答案为:冷却到26~42℃结晶;过滤;
(3)氯化铜与N2H4反应得到CuCl,氧化产物为无毒气体,即为氮气,由元素守恒可知,反应还生成HCl,反应离子方程式为:4Cu2++4Cl-+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$4CuCl↓+N2↑+4H+;
由于CuCl在热水中迅速水解生成氧化铜水合物,应微热维持反应发生,防止CuCl水解生成氧化铜水合物;
故答案为:4Cu2++4Cl-+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$4CuCl↓+N2↑+4H+;微热维持反应发生,温度过高生成氧化铜水合物;
(4)根据Cu元素守恒,CuCl2•2H2O理论质量为$\frac{100g×96%}{64g/mol}$×171g/mol=256.5g,故其产率为$\frac{277g}{256.5g}$×100%=108%;在调节溶液pH时,加入CuO反应生成了CuCl2,使产品质量增加,
故答案为:108%;在调节溶液pH时,加入CuO反应生成了CuCl2,使产品质量增加.
点评 本题考查实验制备方案,涉及对装置的分析评价、物质的分离提纯、对操作的分析评价、含量测定等,注意对题目信息的提取应用,侧重考查学生分析解决问题的能力、知识迁移运用能力,难度中等.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子从发生还原反应的电极流出 | |
| B. | 原电池的两极一定是由活泼性不同的两种金属组成 | |
| C. | 燃料电池的转化率为100% | |
| D. | 原电池中的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 部分结构知识 | 部分性质 | |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3 (n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴的四氯化碳溶液可鉴别CH4和C2H4 | |
| B. | “西气东输”中的“气”指的是煤气 | |
| C. | 乙烯、聚乙烯分子中均含有碳碳双键,均可使酸性KMnO4溶液褪色 | |
| D. | 石油裂化主要得到乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com