
【题目】有两种短周期元素![]() 、
、![]() ,
,![]() 元素原子的最外层电子数为
元素原子的最外层电子数为![]() ,次外层电子数为
,次外层电子数为![]() ;
;![]() 元素原子的
元素原子的![]() 层(有电子)电子数为
层(有电子)电子数为![]() ,
,![]() 层电子数为
层电子数为![]() 。
。
(1)推断元素名称和符号:![]() _______、______,
_______、______,![]() ______、_______。
______、_______。
(2)![]() 、
、![]() 两元素形成的化合物可能具有的性质是_______(填序号)。
两元素形成的化合物可能具有的性质是_______(填序号)。
A.能与水反应 B.能与硫酸反应 C.能与氢氧化钠溶液反应
(3)![]() 元素的原子含有_______个能层,Y元素的原子含有_______个能层。
元素的原子含有_______个能层,Y元素的原子含有_______个能层。
【答案】氧 O 硅 Si C 2 3
【解析】
短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则L层电子数为8,所以a+b=8,所以元素X原子有2个电子层,故b=2,所以a=8-b=8-2=6,故X为O元素;故元素Y原子的M层电子数为a-b=6-2=4,Y为Si元素,X、Y两元素形成的化合物为SiO2,结合元素化合物的性质判断。
(1)X为O元素,Y为Si元素,故答案为:氧;O;硅;Si;
(2)X、Y两元素形成的化合物为SiO2;
A.SiO2不与水反应,故A错误;
B.SiO2性质稳定,溶于HF酸,不溶于其它酸,故B错误;
C.SiO2与氢氧化钠反应生成硅酸钠与水,故C正确;
D.SiO2不与氯气反应,故D错误;
故答案为:C;
(3)氧原子和硅原子的原子结构示意图分别为: 、
、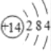 ,所以氧原子有2个能层,硅原子有3个能层,故答案为:2;3。
,所以氧原子有2个能层,硅原子有3个能层,故答案为:2;3。


科目:高中化学 来源: 题型:
【题目】以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=-ΔH1-ΔH2
B.在不同油耗汽车中发生反应③,ΔH3会不同
C.植物的光合作用通过反应①将热能转化为化学能
D.反应④C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH4,则ΔH3>ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人工固氮最重要的途径,反应的热化学方程式如下:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1。
2NH3(g) ΔH=-92.4kJ·mol-1。
(1)工业上有利于提高合成氨产率的条件有___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)关于合成氨的说法,正确的是__。
A.合成氨反应的ΔH和ΔS都小于零
B.控制在773K下反应,目的是加快反应速率和提高平衡转化率
C.将NH3液化后移去,利于反应速率提高和平衡正向移动
D.原料气须经过净化处理,以防止催化剂中毒和事故发生
(3)若N2、H2的初始投入量分别为0.1mol、0.3mol,在恒容容器中反应,平衡后混合物中氨的体积分数(ψ)与温度、压强的关系如图所示。

①比较p2、p3的大小:p2__p3(填“>”“<”或“=”),其原因是__。
②比较平衡时A、B点对应的化学反应速率:VA(N2)__VB(N2)(填“>”“<”或“=”)。
③若起始压强为1×108Pa,则平衡时B点的压强为___Pa。
(4)科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨,阴极区发生的变化可按两步进行。已知第一步的反应为:Fe2O3+6e-+3H2O=2Fe+6OH-,则第二步的反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的部分元素,请回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素的符号:①______,⑥______,⑦______。
(2)上述表中的元素中,最活泼的金属元素是______(填元素符号,下同),非金属性最强的元素是______,最不活泼的元素是______。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是______(填化学式,下同),碱性最强的是______,属于两性氢氧化物的是______,写出这三种物质之间相互反应的化学方程式:______,______,______。
(4)上述表中的元素(不考虑0族元素)中,原子半径最小的是______(填元素符号,下同),原子半径最大的是______。
(5)在③与④中,化学性质较活的是______(填元素符号);在⑧与中,其单质的氧化性较强的是______(填元素符号),请设计实验加以证明:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关认识正确的是
A.各能级按![]() 、
、![]() 、
、![]() 、
、![]() 的顺序所容纳的最多电子数依次为1、3、5、7的2倍
的顺序所容纳的最多电子数依次为1、3、5、7的2倍
B.各能层的能级都是从![]() 能级开始至
能级开始至![]() 能级结束
能级结束
C.各能层含有的能级数为![]()
D.各能层含有的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷分子是以碳原子为中心的正四面体结构,而不是平面正方形结构。可佐证该说法的事实是( )
A.![]() 只有一种结构B.
只有一种结构B.![]() 只有一种结构
只有一种结构
C.![]() 只有一种结构D.
只有一种结构D.![]() 的四个价键的键长、键角、键能完全相同
的四个价键的键长、键角、键能完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是用不同方法表示的几种有机物:
① ②
②![]() ③
③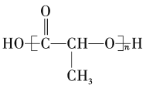 ④
④
⑤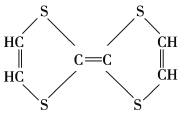 ⑥
⑥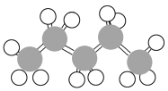
⑦
⑧
(1)上述表示方法中属于结构简式的为______(填序号,下同);属于结构式的为______;属于键线式的为______;属于比例模型的为______;属于球棍模型的为______。
(2)写出⑧中所含官能团的电子式:______、______。
(3)①的分子式为______,最简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比为
A.8:1B.2:1C.3:2D.2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=____。酸碱按体积比为1:10混合后溶液显中性,则a+b=____________。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为__________mo1·L–l,B溶液中水电离出的氢离子浓度为____________mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA _____________VB,混合后溶液中的离子浓度关系为c(Na+)___________c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com