
柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法正确的是
 A.它的一氯代物有6种
A.它的一氯代物有6种
B.它的分子中所有的碳原子一定在同一平面上
C.一定条件下,它可以发生加成、取代、氧化、还原等反应
D.它和丁基苯( )互为同分异构体
)互为同分异构体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
已知25℃、101 kPa条件下:4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2834.9 kJ/mol
4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3119.1 kJ/mol,由此得出的结论正确的是( )
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应 D.O2比O3稳定,由O2变O3为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2CH3COCH3(l)  CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如右图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如右图所示。下列说法正确的是
 A.b代表0℃下CH3COCH3的Y-t 曲线
A.b代表0℃下CH3COCH3的Y-t 曲线
B.反应进行到20min末,CH3COCH3的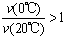
C.升温可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的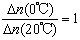
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式 ;写出该反应的化学平衡常数表达式K= ;降低温度,该反应的K值 。(填“增大”、“减小”或“不变”)
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ;△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
 若1mol NH3还原NO生成N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
若1mol NH3还原NO生成N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
(4)肼(N2H4)在空气中燃烧的热化学方程式为
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H= —534kJ/mol
肼-空气燃料电池是一种碱性电池,电解质溶液是20~30%的KOH溶液,如右图所示。
写出该电池的负极反应式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某200mL稀硫酸和稀硝酸的混合溶液最多能溶解 19.2g铜粉(已知硝酸只被还原为NO气体),若再取等体积的该混合酸向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列有关分析错误的是
A.原混合酸中NO3—的物质的量为0.2 mol
B.原混合酸中H2SO4物质的量浓度为2 mol/L
C.取25mL原混合酸加水稀释至1 L后溶液的pH =1
D.OA段与BC段反应中电子转移的物质的量之比为3:1

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.氨气是非电解质,氨水是电解质
B.氢氧化铁胶体可以发生丁达尔现象
C.摩尔和物质的量均是联系宏观和微观数量的物理量
D.二氧化硅既可和酸又可和碱反应,所以二氧化硅是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.68g铁粉加入到30.0mL的1.00 mol·L-1MO2+溶液中,恰好完全反应,向溶液中滴加KSCN溶液,溶液颜色没有变化,则还原产物可能是
A.M B.M+ C.M2+ D.M3+
查看答案和解析>>
科目:高中化学 来源: 题型:
为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。已知:
| 水解反应 | 平衡常数(K) |
| Fe3+ + 3H2O | 7.9 × 10-4 |
| Fe2+ + 2H2O | 3.2 × 10-10 |
| Cu2+ + 2H2O | 3.2 × 10-7 |
请回答:(1)稀硝酸和Cu反应的化学方程式为
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、硝酸钠溶液、稀盐酸。方案:
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化。 |
①据实验现象写出发生反应的离子方程式:
②导致实验过程中溶液pH略有上升的可能原因是
③解释乙同学的实验现象
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com