
 钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+
钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+分析 (1)锰原子序数为25,根据能量最低原则、泡利不相容原理和洪特规则综合考虑,写出核外电子排布式;
(2)反应2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+中,涉及的元素属干同主族元素为O和S,同主族,自上而下第一电离能降低;
(3)①根据价层电子对=σ 键电子对+中心原子上的孤电子对,结合S2O8 2-结构判断杂化类型;
②氧化还原反应中,元素的化合价降低,被还原;
③活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键、同种非金属元素之间易形成非极性键,根据S2O8 2-结构分析解答;
(4)①由此结构可知,此单元中含有水分子的个数为:20,其中每个水分子属于三个五元环,据此计算氢键;
②冰中氢键的作用能为18.8kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中仍在氢键.
解答 解:(1)锰原子序数为25,质子数为25,原子核外电子数为25,根据能量最低原则、泡利不相容原理和洪特规则,Mn的电子排布式为[Ar]3d54s2,
故答案为:[Ar]3d54s2;
(2)同主族自上而下第一电离能减小,O、S同主族,所以第一电离能由大到小的顺序为O>S,故答案为:O>S;
(3)①H2S2O8中,硫原子价层电子对数=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$(6-4×1-2)=4,所以采取sp3杂化,
故答案为:sp3杂化;
②该反应中,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),所以被还原的元素为S,
故答案为:S;
③由反应可知,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),生成10molSO42-转移电子10mol电子,则每生成1 mol MnO4-,转移电子5mol电子,S2O8 2-断裂2.5mol(或2.5NA)O-O间非极性共价键,
故答案为:2.5NA;
(4)①由此结构可知,此单元中含有水分子的个数为:20,其中每个水分子形成的氢键属于2个五元环,故每个水分子形成氢键个数为:$\frac{3}{2}$,故总共形成氢键数为:20×$\frac{3}{2}$=30,
故答案为:30;
②冰中氢键的作用能为18.8kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中仍在氢键,
故答案为:液态水中仍然存在大量氢键.
点评 本题考查核外电子排布、氧化还原反应、第一电离能、杂化、共价键类型、晶胞的计算等知识点,氧化还原反应须把握反应中元素的化合价变化,熟练应用杂化理论,掌握第一电离能变化规律为解答的关键,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
 如图所示为实验室制取少量溴苯的装置,回答下列问题:
如图所示为实验室制取少量溴苯的装置,回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有的碳碳双键数目为1.5NA | |
| B. | 常温常压下,2.8g由N2和CO组成的混合气体中含有的原子数为0.1NA | |
| C. | 25℃时,1.0LpH=12的Na2CO3溶液中含有的阴离子数大于0.01NA | |
| D. | 在反应:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,生成1molCu,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、丙两液体均可产生丁达尔现象 | |
| B. | 乙中产生的气泡能使BaCl2溶液变浑浊 | |
| C. | 若忽略溶液体积的变化,则烧杯中c(Cl-)不变 | |
| D. | 若将CaC03换成CaS04,也可得到相同的实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( ) | |
| B. | 积极推行和使用能被微生物降解的新型聚合物材料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 废旧电池应集中回收,不能填埋处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
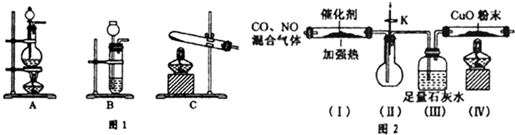
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60,.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.
已知如表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.| CH2COOH | HClO | H2CO2 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 浓H2SO4不稳定,光照易分解 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com