
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。


如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+CO32-
C. 图象中a点的酸的总浓度大于b点酸的总浓度
D. 图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
【答案】D
【解析】A.醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;B.碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;C.pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故C错误;D.在![]() 的分子、分母同时乘以氢离子浓度可得:
的分子、分母同时乘以氢离子浓度可得:![]() ,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故D正确;故选D。
,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
(1)夏天的食品易变霉,在冬天不易发生该现象 ;
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢 ;
(3)MnO2加入双氧水中放出气泡更快 .
Ⅱ:在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
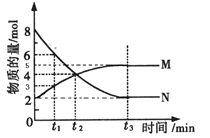
(1)比较t2时刻,正逆反应速率大小V正 V逆.(填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为: .
(3)t3时刻化学反应达到平衡,反应物的转化率为 .
(4)如果升高温度,则V逆 (填增大、减小或不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。请回答下列问题:

(1)电源中Y电极为直流电源的__________极。
(2)pH变化:A:________B:________ C:_________(填“增大”、“减小”或“不变”)。
(3)若A中KCl溶液的体积是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Ksp[(CH3)2NH)]=l.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
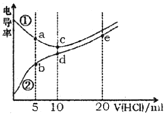
A. 曲线①代表滴定二甲胺溶液的曲线
B. a点溶液中:c[(CH3)2NH2+]>c[CH3]2NH·H2O]
C. d点溶液中:c(H+)=c(OH-)+c[CH3]2NH·H2O]
D. b、c、e三点的溶液中,水的电离程度最大的是b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为___________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)___________。
(3)YX4M的电子式为___________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为____________________。
(4)X、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为__________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油和煤中提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______________,B的结构简式_________________;
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_________________________________________________________;
(3)在碘水中加入B振荡静置后的现象_________________________;
(4)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为______,并写出其所有可能的结构简式:__________________。
(2)某烷烃的相对分子质量为128,该烷烃的化学式为__________________。
(3)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气混合,点燃完全反应后再恢复到原来的温度时,气体体积不变,则该烃分子内的氢原子个数______。
A.小于4 B.大于4
C.等于4 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.地球上99%溴蕴藏在大海中,故溴被称为“海洋元素”
B.高压钠灯发出的黄光射程特别远,故常用于道路与广场的照明
C.碳酸氢钠可与盐酸反应,故可作治疗胃酸过多的药剂
D.利用光线在硅晶体内的全反射现象,可以制备光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物作为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为2NH4ClO4 ![]() N2↑+4H2O+Cl2↑+2O2↑,下列对此反应的叙述,错误的是( )
N2↑+4H2O+Cl2↑+2O2↑,下列对此反应的叙述,错误的是( )
A. 此反应属于分解反应
B. 此反应中高氯酸铵只起氧化剂作用
C. 上述反应瞬间产生大量高温气体推动航天飞机飞行
D. 此反应从能量变化上说,主要是化学能转化为热能和动能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com