
(16分)Na2S2O8溶液可降解有机污染物4-CP,原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-)。通过测定4-CP降解率可判断Na2S2O8溶液产生(SO4-·)的量。某研究小组探究溶液酸碱性、Fe2+的浓度对产生(SO4-·)的影响。

(1)溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强, (填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
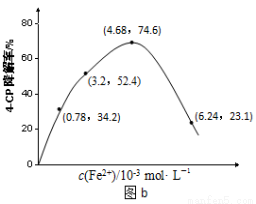
(2)Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。
已知 S2O82- + Fe2+= SO4-·+ SO42- + Fe3+,此外还可能会发生:SO4-· + Fe2+ = SO42- + Fe3+
① 实验开始前,检验FeSO4溶液是否被氧化的试剂是 (化学式)。如被氧化可以观察到的现象是 。
②当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为 %,4-CP降解的平均反应速率的计算表达式为 。
③当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是 。
(1) 有利于 (3分)
(2)① KSCN (2分); 溶液呈红色; (2分)
②52.4 (3分)
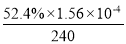
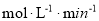 (3分)
(3分)
③Fe2+浓度过高时,Fe2+会与SO4—,发生反应,消耗部分SO4—,导致4-CP降解率下降。(3分)
【解析】
试题分析:⑴据图a分析,PH越小(酸性越强),4-CP的降解率增大,则Na2S2O8溶液产生SO4-的量增多,即溶液酸性增强,有利于Na2S2O8产生SO4-。
⑵①FeSO4溶液被氧化产生Fe3+,可向溶液中加入KSCN检验,若溶液变红说明FeSO4溶液已被氧化,反之,没有被氧化。
②据图b中的数据分析知,当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为52.4%;则4-CP降解的平均反应速率的计算表达式为=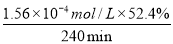 =
=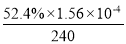
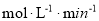 ;
;
③当Fe2+浓度过高时,Fe2+会与SO4—发生氧化还原反应,消耗部分SO4—,反而导致4-CP的降解率下降。
考点:考查化学图像与化学原理的综合应用。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
 (1)已知:2NO2(g)
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
其他条件不变时,下列措施不能使NO2转化率提高的是

 A.减少NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
A.减少NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2 O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。
 (4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合1 题型:简答题
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是 周期 族。
(2)A与C形成的18电子分子的结构式为 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如右图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。
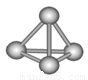
A.B4比P4(白磷)既含有极性键又含有非极性键
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
T/K | 303 | 313 | 323 |
BA3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),
原子核内质子数为(2n2一1)。下列关于元素X的说法中,不正确的是( )
A.其最高化合价一定为+5 B.可以形成化学式为KXO3的盐
C.其氢化物可以用来做喷泉实验 D.其最高价氧化物的水化物是强酸
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
决定元素种类的因素是( )
A.核外电子数 B.最外层电子数 C.核电荷数 D.中子数
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
对于常温下pH=2的盐酸和pH=3的醋酸,下列说法正确的是
A.pH=2的盐酸中:c(H+)=c(Cl-) + c(OH-)
B.pH=3的醋酸中:c(H+)=3.0 mol·L-1
C.pH=2的盐酸与pH=3的醋酸中溶质的物质的量浓度之比为10:1
D.pH=3的醋酸与pH=11的NaOH溶液等体积混合所得溶液中:c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为
A.10mol B.11mol C.12mol D.13mol
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.3铜及其化合物 金属材料与复合材料练习卷(解析版) 题型:选择题
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可生成CuH。下列叙述中错误的是( )。
A.“某物质”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.2氮的循环练习卷(解析版) 题型:填空题
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g样品与2.0 mol·L-1 NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示。请回答下列问题:
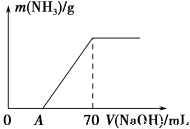
(1)A点前样品与NaOH反应的离子方程式为 。
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 (填字母序号)。
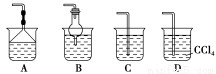
(3)样品中(NH4)2CO3的质量分数是 %(保留一位小数)。
(4)当V(NaOH)=50 mL时,生成NH3的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com