
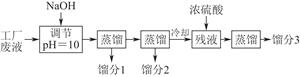
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
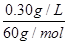 =0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。
=0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。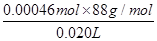 =2.024 g·L-1。
=2.024 g·L-1。

科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用激光笔照射淀粉溶液和葡萄糖溶液,能产生光亮的“通路”的是淀粉溶液 |
| B.将某气体通入淀粉碘化钾溶液中,溶液变蓝色,该气体一定是Cl2 |
| C.向某溶液中加入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl— |
| D.向某稀溶液中加入少量NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.检验亚硫酸钠试样是否变质:试样 白色沉淀 白色沉淀 沉淀不溶解―→说明试样已变质 沉淀不溶解―→说明试样已变质 |
B.除去粗盐中含有的硫酸钙杂质粗盐   精盐 精盐 |
C.检验某溶液中是否含有Fe2+试样 溶液颜色无变化 溶液颜色无变化 溶液变红色―→溶液中含有Fe2+ 溶液变红色―→溶液中含有Fe2+ |
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液 溶液变蓝色―→氧化性:H2O2>I2 溶液变蓝色―→氧化性:H2O2>I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用pH试纸鉴别 |
| B.分别用闻气味和pH试纸鉴别 |
| C.分别用BaCl2和NaOH溶液鉴别 |
| D.用Ba(OH)2溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 、⑥S
、⑥S 离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )
离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈紫红色 |
| ③ | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
查看答案和解析>>
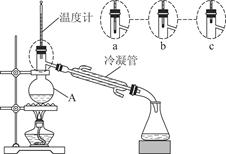
科目:高中化学 来源:不详 题型:实验题

| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
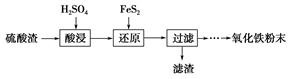
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com